题目内容
19.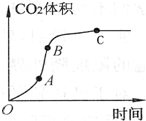 某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积
某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是( )
| A. | AB段反应速率最快的原因可能是反应放热,体系温度升高 | |
| B. | BC段反应速率变慢的原因可能是盐酸浓度降低 | |
| C. | 该反应速率也可以用CaCl2的浓度变化与时间关系来表示 | |
| D. | C点后CO2体积不变的原因一定是盐酸消耗完 |
分析 斜率表示反应速率,斜率越大反应速率越快,随反应进行氢离子浓度降低,反应放热,反应开始温度影响比氢离子浓度影响大,反应速率加快,到反应后阶段,氢离子浓度降低较大,浓度影响比温度影响大,反应减慢,据此分析.
解答 解:A、反应放热,反应开始温度影响比氢离子浓度影响大,反应速率加快,故A正确;
B、到反应后阶段,氢离子浓度降低较大,浓度影响比温度影响大,反应减慢,故B正确;
C、CaCl2是生成物,可以用生成物浓度变化表示反应速率,故C正确;
D、C点后CO2体积不变的原因不一定是盐酸消耗完,可能是大理石消耗完,故D错误;
故选D.
点评 以图象为载体,考查外界条件对反应速率的影响,是对知识的综合运用,难度中等,关键关键图象分析速率变化原因.注意对影响化学反应速率的因素分析.

练习册系列答案
相关题目
7.下列叙述及评价均合理的是( )
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218 O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有. |
| B | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性. |
| C | 向卤代烃水解后的溶液中加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀. |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液. |
| A. | A | B. | B | C. | C | D. | D |
14.下列元素中,原子半径最小的是( )
| A. | Li | B. | Na | C. | F | D. | Cl |
11.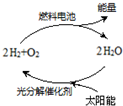 能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
 能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
8.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子序数大于y的原子序数 | |
| B. | x的电负性小于y的电负性 | |
| C. | x的离子半径大于y的离子半径 | |
| D. | x的第一电离能小于y 的第一电离能 |
9.如表所示,为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
 和一个
和一个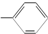 ,则该有机物可能的结构有(不考虑立体异构)( )
,则该有机物可能的结构有(不考虑立体异构)( )