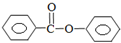题目内容
17.已知热化学方程式:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,下列有关说法正确的是( )| A. | 每消耗1molH2(g)释放483.6kJ的能量 | |
| B. | 每生成1molH2O(g)释放483.6kJ的能量 | |
| C. | 方程式中H2(g)计量数改变△H值不变 | |
| D. | 同条件下2molH2O(g)完全分解吸收的能量为483.6kJ |
分析 据氢气燃烧的热化学方程式分析可知,2mol氢气与1mol氧气燃烧生成2mol水蒸气放热483.6KJ,结合正逆反应焓变数值相等,符合相反解答.
解答 解:A、由氢气燃烧的热化学方程式可知,2mol氢气与1mol氧气燃烧生成2mol水蒸气放热483.6KJ,故A错误;
B、由氢气燃烧的热化学方程式可知,每生成2molH2O(g)释放483.6kJ的能量,故B错误;
C、焓变与系数成正比,故C错误;
D、正逆反应焓变数值相等,符合相反,所以同条件下2molH2O(g)完全分解吸收的能量为483.6kJ,故D正确;
故选:D.
点评 本题考查了热化学方程式的含义,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
12.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、甲苯均不能使酸性KMnO,溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | C4H10有三种同分异构体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
2.可逆反应2SO2(g)+O2═2SO3(g)△H<0,达到平衡后,在其他条件不变的情况下改变下列条件,SO2转化率减小的是( )
| A. | 降低温度 | B. | 保持压强充入N2 | ||
| C. | 保持体积不变,增加O2 | D. | 增大压强 |
9.在一恒温恒容的密闭容器中,可逆反应2SO2(g)+O2(g)═2SO3(g))达到平衡,测得平衡时n(SO2):n(O2):n(SO3)=3:3:2.若维持温度和容积不变,以3:3:2的物质的量之比再充入SO2、O2、SO3,下列判断正确的是( )
| A. | 平衡不会发生移动 | B. | SO3的质量分数增大 | ||
| C. | 混合气体的密度减小 | D. | 混合气体的平均相对分子质量不变 |
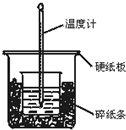 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题: 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.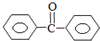 $→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$
$→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$