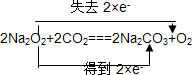题目内容
用双线桥法标出电子转移的方向和数目,并指出反应的氧化剂与还原剂
Zn+H2SO4═ZnSO4+H2↑________
氧化剂:________ 还原剂:________.
 H2SO4 Zn
H2SO4 Zn分析:根据反应物中含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,并根据化合价的变化确定转移的电子总数,标出电子转移的方向和数目.
解答:在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,
该反应中转移的电子数为2e-,电子转移的方向和数目为
 ,故答案为:
,故答案为: ;H2SO4;Zn.
;H2SO4;Zn.点评:本题考查氧化还原反应,明确元素的化合价变化即可解答,难度不大.

练习册系列答案
相关题目