题目内容
下列判断正确的是( )
| A、第三、四周期同主族元素的原子序数相差8 |
| B、任何原子都是核外电子层数等于该元素在周期表中的周期数 |
| C、短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素 |
| D、短周期中族序数与周期数相同的元素是H、Be |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:A.左侧时相差8,右侧时相差18个;
B.由原子结构可确定元素的位置,电子层数=周期数;
C.短周期为1、2、3周期,次外层电子数是最外层电子数2倍的元素可能为Li、Si;
D.短周期中族序数与周期数相同的元素,可能为H、Be、Al.
B.由原子结构可确定元素的位置,电子层数=周期数;
C.短周期为1、2、3周期,次外层电子数是最外层电子数2倍的元素可能为Li、Si;
D.短周期中族序数与周期数相同的元素,可能为H、Be、Al.
解答:
解:A.第三、四周期同主族元素的原子序数在左侧相差8,等于第三周期元素的种类数,若在右侧相差18,故A错误;
B.由原子结构可确定元素的位置,电子层数=周期数,则任何原子都是核外电子层数等于该元素在周期表中的周期数,故B正确;
C.短周期为1、2、3周期,次外层电子数是最外层电子数2倍的元素可能为Li、Si,若为Li为金属元素,故C错误;
D.短周期中Al在第三周期第ⅢA族,族序数与周期数相同的元素,符合条件的还有H、Be,故D错误;
故选B.
B.由原子结构可确定元素的位置,电子层数=周期数,则任何原子都是核外电子层数等于该元素在周期表中的周期数,故B正确;
C.短周期为1、2、3周期,次外层电子数是最外层电子数2倍的元素可能为Li、Si,若为Li为金属元素,故C错误;
D.短周期中Al在第三周期第ⅢA族,族序数与周期数相同的元素,符合条件的还有H、Be,故D错误;
故选B.
点评:本题考查周期表的结构及应用,为高频考点,把握元素的位置、原子结构与位置的关系、原子的电子排布规律为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
元素X、Y和Z可结合形成常见化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期.下列有关推测合理的是( )
| A、XYZ3是一种含氧酸,且X与Y可形成共价化合物XY |
| B、XYZ3是一种含氧酸,且Y与Z可形成共价化合物YZ2 |
| C、XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ |
| D、XYZ3是一种易溶于水的盐,且Y与Z可形成共价化合物YZ |
可以证明乙酸是弱酸的事实是( )
| A、乙酸和水能任意比例混溶 |
| B、乙酸水溶液能使紫色石蕊试液变红色 |
| C、醋酸能与碳酸钠溶液反应生成CO2气体 |
| D、在25℃时,1mol/L的CH3COONa溶液的pH约为9 |
已知丙氨酸的结构简式为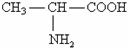 ,则下列说法不正确的是( )
,则下列说法不正确的是( )
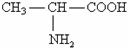 ,则下列说法不正确的是( )
,则下列说法不正确的是( )A、丙氨酸与氢氧化钠溶液反应生成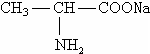 |
B、丙氨酸与盐酸反应生成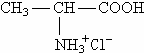 |
C、丙氨酸分子间发生成肽反应生成二肽的结构为 |
| D、丙氨酸不属于a-氨基酸 |
Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2++2H2O?Fe(OH)2+2H+,往该溶液中滴加盐酸,不能发生的变化是( )
| A、平衡向逆反应方向移动 |
| B、溶液由浅绿色变成黄色 |
| C、平衡向正反应方向移动 |
| D、能产生气体 |
下列气体中,既能用浓硫酸干燥,又能用氢氧化钠干燥的是( )
| A、SO2 |
| B、NO2 |
| C、H2 |
| D、NH3 |
我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4═Cu+FeSO4.有关该反应的说法正确的是( )
| A、Fe是氧化剂 |
| B、CuSO4是还原剂 |
| C、Fe被氧化 |
| D、CuSO4发生氧化反应 |
下列事实一般不能用于判断金属性强弱的是( )
| A、金属的颜色和熔沸点 |
| B、金属元素的最高价氧化物对应的水化物的碱性强弱 |
| C、1mo金属单质在反应中失去电子的多少 |
| D、金属元素的单质和水或酸置换出氢的难易 |
 的名称是
的名称是