题目内容
9. 苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H
苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H(1)已知:H2和CO的燃烧热(△H)分别为-285.8kJ.mol•L-1和-283.0kJ.mol•L-1;
C6H5CH2CH3(g)+CO2(g)?C6H5CH=CH2(g)+CO(g)+H2O(I)△H=+114.8kJ•mol-1
则制取苯乙烯反应的△H为+117.6KJ/mol
(2)向密闭容器中加入1mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ.下列说法正确的是BD.
A.升高温度,正反应速率减小,逆反应速率增大
B.若继续加入1mol乙苯,苯乙烯转化率增大
C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小
D.相同条件下若起始加入1mol苯乙烯和1mol氢气,达平衡时反应能量变化为(△H-Q)kJ
(3)向2L密闭容器中加入1mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温
度的关系如图所示.700℃时,乙苯的平衡转化率为66.7%,此温度下该反应的平衡常数为$\frac{2}{3}$;温度高于970℃时,苯乙烯的产率不再增加,其原因可能是有机化合物在温度过高时分解.
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2,该阳极的电极反应式为C6H5CH=CH2+16H2O-40e-=8CO2↑+40H+,若去除0.5mol苯乙烯,两极共收集气体14mol.
分析 (1)H2和CO的燃烧热(△H)分别为-285.8kJ.mol•L-1和-283.0kJ.mol•L-1,可得热化学方程式:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ/mol,
已知③:C6H5CH2CH3(g)+CO2(g)?C6H5CH=CH2(g)+CO(g)+H2O(l)△H=+114.8kJ/mol,
根据盖斯定律,③+②-①可得:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g);
(2)A.升高温度,正逆反应速率均增大;
B.若继续加入1mol乙苯,等效为增大压强,平衡逆向移动;
C.压缩容器的体积,增大体系的压强,平衡向气体体积减小的方向移动,乙苯的浓度增大,平衡常数不变,故平衡时苯乙烯、氢气的浓度也增大;
D.相同条件下若起始加入1mol苯乙烯和1mol氢气,等效为开始加入1mol乙苯,与原平衡为完全等效平衡,平衡时乙苯的物质的量相等,再计算反应热;
(3)由图示可知:700℃时,乙苯的物质的量百分含量为20%,参加反应的乙苯为xmol,则:
C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)
起始量(mol):1 0 0
变化量(mol):x x x
平衡量(mol):1-x x x
再根据乙苯的物质的量分数列方程计算x,进而计算乙苯的转化率;
计算各组分平衡浓度,代入平衡常数表达式K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})×c({H}_{2})}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})}$计算;
有机物受热易分解,温度高于970℃时,可能是应有机物分解使苯乙烯的产率不再增加;
(4)由题目信息可知,阳极上整个过程是苯乙烯氧化生成二氧化碳,由守恒守恒可知,应有OH- 离子生成,由元素守恒可知,应有水参与反应;阴极上是氢离子获得电子生成氢气,阴极电极反应式为:2H2O+2e-=H2+2OH-,根据阳极反应式计算生成二氧化碳物质的量,根据电子转移守恒计算阴极生成氢气物质的量.
解答 解:(1)H2和CO的燃烧热(△H)分别为-285.8kJ.mol•L-1和-283.0kJ.mol•L-1,可得热化学方程式:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ/mol,
已知③:C6H5CH2CH3(g)+CO2(g)?C6H5CH=CH2(g)+CO(g)+H2O(l)△H=+114.8kJ/mol,
根据盖斯定律,③+②-①可得:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g),故△H=114.8KJ/mol-283.0KJ/mol+285.8KJ/mol=+117.6KJ/mol,
故答案为:+117.6KJ/mol;
(2)A.温度变化对正逆反应速率的影响是一致的,只是改变的程度不同,所以升高温度,正反应速率和逆反应速率均增大,故A错误;
B.若继续加入1mol乙苯,相当于增大整个体系的压强,增大压强,平衡逆向移动,故苯乙烯转化率增大,B正确;
C.压缩容器的体积,增大体系的压强,平衡向气体体积减小的方向移动,乙苯的浓度增大,平衡常数不变,故平衡时苯乙烯、氢气的浓度也增大,故C错误;
D.相同条件下若起始加入1mol苯乙烯和1mol氢气,等效为开始加入1mol乙苯,与原平衡为完全等效平衡,平衡时乙苯的物质的量相等,假设平衡时为amol乙苯,则原平衡反应中能量变化为QkJ=(1-a)×△H kJ,而生成amol乙苯的能量变化为:a×△H kJ=(△H-Q)kJ,故D正确;
故答案为:BD;
(3)参加反应的乙苯为xmol,则:
C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)
起始量(mol):1 0 0
变化量(mol):x x x
平衡量(mol):1-x x x
由图示可知:700℃时,乙苯的物质的量百分含量为20%,则$\frac{1-x}{1-x+x+x}$=20%,所以x=$\frac{2}{3}$,乙苯的平衡转化率为$\frac{2}{3}$×100%=66.7%,
此温度下平衡常数K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})×c({H}_{2})}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})}$=$\frac{\frac{x}{2}×\frac{x}{2}}{\frac{1-x}{2}}$=$\frac{2}{3}$,
温度高于970℃时,苯乙烯的产率不再增加,可能有机物受热易分解是所致;
故答案为:66.7%;$\frac{2}{3}$;有机化合物在温度过高时分解;
(4)由题目信息可知,阳极上整个过程是苯乙烯氧化生成二氧化碳,由守恒守恒可知,应有OH- 离子生成,由元素守恒可知,应有水参与反应,阳极电极反应式为:C6H5CH=CH2+16H2O-40e-=8CO2↑+40H+,阴极上是氢离子获得电子生成氢气,阴极电极反应式为:2H2O+2e-=H2↑+2OH-,
除去0.5mol苯乙烯,则:
C6H5CH=CH2+16H2O-40e-=8CO2↑+40H+
0.5mol 20mol 4mol
2 H2O+2 e-=H2↑+2OH-
20mol 10mol
故两极共收集气体:4mol+10mol=14mol,
故答案为:C6H5CH=CH2+16H2O-40e-=8CO2↑+40H+;14.
点评 本题考查化学平衡计算及影响元素、反应热计算、电解原理应用等,(4)中电极反应式书写为易错点,综合考查学生阅读获取信息能力、应用知识分析解决问题能力,难度中等.

| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |

关于该固体混合物,下列说法正确的是( )
| A. | 一定含有Al,其质量为4.5g | |
| B. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定不含FeCl2,可能含有MgCl2和AlCl3 |
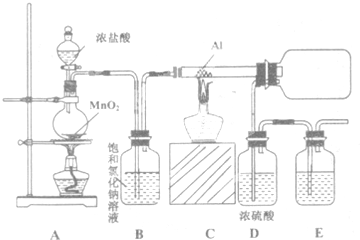
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3加入浸出液后生成NaCl,写出反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)加Na2CO3调pH至5.2的目的是为完全沉淀Fe3+、Al3+.
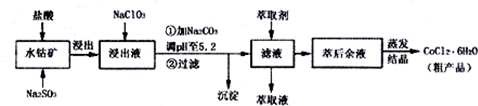
(4)萃取剂对金属离子的萃取率与pH的关系如图1,萃取剂的作用是除去溶液中的Mn2+,其使用的适宜pH范围是C.A.1.0~2.0 B.2.0~2.5 C.3.0~3.5 D 4.0~4.5
(5)取部分加入萃取剂后的混合液,在实验室按流程图获得粗产品.
①使用分液漏斗前要检漏,是检查玻璃塞、旋塞芯是否漏水,若发现其中一处漏水,必要的操作或做法是若发现玻璃塞处漏水,更换分液漏斗,若发现旋塞芯处漏水,则用纸或干布擦净旋塞或旋塞孔,在旋塞芯上涂一层薄薄的润滑脂,将旋塞芯塞进旋塞内,旋转数圈,使润滑脂均匀分布后将旋塞关闭好.(只写出其中一种漏水对应的操作或做法)
②在蒸发过程中为防止产生杂质或脱水,当较多晶体析出时,改为抽滤得到晶体.
写出抽滤装置(如图2)中指定仪器的名称:A安全瓶,B抽气泵.
下列抽滤操作或说法正确的是ABE
A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
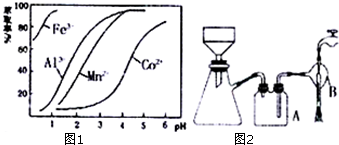
C.注意吸滤瓶内液面高度,当接近支管口位置时,拨掉橡皮管,滤液从支管口倒出
D.用抽滤洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物,以减少沉淀物损失
E.抽滤不宜用于过滤胶状或颗粒太小的沉淀
用少量蒸馏水洗涤晶体,判断晶体是否洗净的具体操作是用洁净的铂丝蘸取最后一次洗涤液在酒精灯火焰上灼烧,如果看到黄色火焰,说明没有洗净,否则已洗净.
| A. | 5min内平均反应速率vA=0.15mol•L-1•min-1 | |
| B. | 当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为放热反应 | |
| C. | 保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行 | |
| D. | t℃,向2L密闭、恒容容器中加入等物质的量的A和B,反应达到平衡状态时,C的物质的量分数仍为60%,则加入A的物质的量为1.6mol |
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应的正反应是吸热反应 | |
| B. | 100℃时,向体积为V1L的恒容密闭容器中充入2mol CO和4mol H2,达到平衡时,CO的转化率为40%,则V1=12 | |
| C. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CO的体积分数为50% | |
| D. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CH3OH(g)的体积分数为62.5% |
| A. | 100 ml. | B. | 250 ml. | C. | 500 ml. | D. | 1 L. |