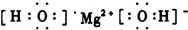题目内容
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素;A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不同周期,也不同主族。请回答:(1)C元素的名称是___________。
(2)A、B、D可组成化学式为D4B
(3)B、D形成的化合物液态时可发生微弱电离(电离过程与D
(4)已知:BA2+A2+D![]() DBA3。如图所示,若将一充满m mL BA2和A2混合气体的大试管倒立于D
DBA3。如图所示,若将一充满m mL BA2和A2混合气体的大试管倒立于D

①若余下n mL气体为___________,原混合气体中BA2的体积为___________mL,A2的体积为___________mL。
②若余下n mL气体为___________,原混合气体中BA2的体积为___________mL,A2的体积为___________mL。
解析:(1)根据题意可知,A、B、C三种元素的位置关系有四种可能,如图,![]() 。经计算可知,只有当A为氧元素、C为硫元素、B为氮元素时符合题意。又A、B、C、D为短周期元素,D与A、B、C不同周期,也不同主族,所以D只能为氢元素。
。经计算可知,只有当A为氧元素、C为硫元素、B为氮元素时符合题意。又A、B、C、D为短周期元素,D与A、B、C不同周期,也不同主族,所以D只能为氢元素。
(2)H4N2O3的离子化合物为NH4NO3,其中 水解呈酸性:
水解呈酸性: +H2O
+H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(3)由于NH3(液态)的电离方式与H2O相似,所以有NH3+NH3![]()
 。
。
(4)设NO2的气体体积为x,O2的体积为y,
则有x+y=mmL ①
若余下的气体为O2,则参加反应的O2为(y-n),根据4NO2+O2+2H2O![]() 4HNO3可知,
4HNO3可知,
4(y-n)=x ②
解①②得:x=0.8(m-n),y=
若余下的气体为NO,由3NO2+H2O![]() 2HNO3+NO知;
2HNO3+NO知;
经上述反应?余下NO2的体积为3nmL;根据4NO2+O2+2H2O![]() 4HNO3知:4y=x-3n③,
4HNO3知:4y=x-3n③,
解①③得:x=
答案:(1)硫 (2) +H2O
+H2O![]() NH3·H2O+H+
NH3·H2O+H+
![]()
(4)①O2 0.8(m-n)
②NO

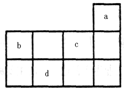 a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )
a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )| A、a原子的最外电子层上有8个电子 | B、c的最高价氧化物对应水化物为强酸 | C、d的原子半径比c的大 | D、b的非金属性比c的强 |


 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
 NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3