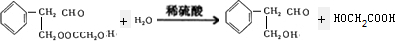
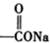题目内容
7.下列有关晶体和非晶体的说法中正确的是( )| A. | 具有规则几何外形的固体均为晶体 | |
| B. | 晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射 | |
| C. | 晶体研碎后即变为非晶体 | |
| D. | 将玻璃加工成规则的固体即变成晶体 |
分析 晶体由固定的熔点,非晶体没有固定的熔点,同时晶体内部排列有规则,而非晶体则没有,但形状不一定有规则,晶体分为单晶体和多晶体:其中单晶体具有各向异性,多晶体和非晶体一样具有各向同性,晶体具有自范性,而非晶体没有自范性.
解答 解:A.具有规则几何外形的固体不一定是晶体,故A错误;
B、晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,x射线衍射可以看到微观结构,即晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射,故B正确;
C.晶体研碎后还是晶体,故B错误;
D.将玻璃加工成规则的固体,玻璃仍然不是晶体,属于玻璃态物质,故D错误;
故选B.
点评 本题考查了晶体和非晶体的判断,根据其特点来分析即可,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下表中对应关系正确的是
| 化学方程式 | 结论 | |
| A | 4Cu0$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑ | 热稳定性:Cu2O>CuO |
| B | 2KClO3+I2$\frac{\underline{\;\;△\;\;}}{\;}$2KIO3+Cl2 | 非金属性:I>Cl |
| C | H2S+CuSO4═CuS↓+H2SO4 | 酸性:H2S>H2SO4 |
| D | CH3COOCH2CH3+H2O?CH3COOH+CH3CH2OH | 反应类型:既是水解反应,也是加成反应 |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法正确的是( )
①H、2H、3H为三种不同的核素;
②H、2H、3H互为同位素;
③H、2H、3H互为同素异形体;
④114号元素位于周期表第七周期VA族;
⑤氢元素质量数为1;
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置;
⑦互为同位素的原子物理性质、化学性质均相同.
①H、2H、3H为三种不同的核素;
②H、2H、3H互为同位素;
③H、2H、3H互为同素异形体;
④114号元素位于周期表第七周期VA族;
⑤氢元素质量数为1;
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置;
⑦互为同位素的原子物理性质、化学性质均相同.
| A. | ①②⑥⑦ | B. | ①②③⑥ | C. | ①②⑥ | D. | ①②③⑥⑦ |
2.下列各组元素中原子序数按由大到小的顺序排列的是( )
| A. | Be.C.B | B. | Li.O.Cl | C. | S.Si.Al | D. | C.S.Mg |
12.下列说法中正确的是( )
| A. | 乙烯中C=C的键能是乙烷中C-C的键能的2倍 | |
| B. | 同一原子中,2p,3p,4p能级的轨道数目依次增多 | |
| C. | C-O键的极性比N-O键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
17.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.
(4)有两种化合物均由①、④、⑤、⑧四种元素形成,两者之间可以相互发生化学反应,其离子反应方程式为:HSO3-+H+=H2O+SO2↑.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.(4)有两种化合物均由①、④、⑤、⑧四种元素形成,两者之间可以相互发生化学反应,其离子反应方程式为:HSO3-+H+=H2O+SO2↑.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
 .
. 的系统命名法的名称为2,2,5,5-四甲基庚烷.
的系统命名法的名称为2,2,5,5-四甲基庚烷.

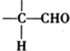 $\stackrel{稀氢氧化钠溶液}{→}$
$\stackrel{稀氢氧化钠溶液}{→}$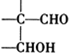 -CHO+
-CHO+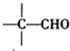 +NaOH(浓)→
+NaOH(浓)→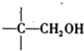 +
+