题目内容
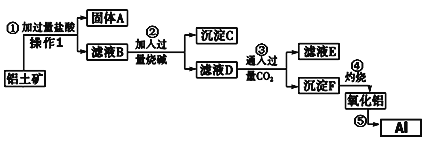
【题目】硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)________________。
(2)Fe粉除调pH外,另一个作用是___________;Fe粉调节溶液的pH为__________。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为_______________________________;
所得滤液的主要溶质是(填化学式)_______________。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为______________________________。
【答案】Fe2+、Fe3+、Al3+ 将溶液中Fe3+还原为Fe2+,便于与Al3+分离 5(4.7~7.6或其之间的任意数值) Fe2++2HCO3-=FeCO3↓+CO2↑+H2O (NH4)2SO4 FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】
硫铁矿烧渣(Fe2O3、Fe3O4,以及少量SiO2、Al2O3等)加入焦炭还原焙烧,大部分Fe2O3、Fe3O4转化为FeO,加入足量硫酸后,溶液中有Fe2+、Fe3+、Al3+,而SiO2不能溶解在酸中,被过滤除去。加入铁粉,把Fe3+还原为Fe2+,同时消耗H+,使溶液的PH增大,除去Al3+,滤液中含有的溶质为FeSO4,加入NH4HCO3,发生反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,得到的被氧气氧化得到Fe2O3。
(1)在硫铁矿烧渣中含有Fe2O3、Fe3O4,以及少量SiO2、Al2O3等,当加入酸时,Fe2O3、Fe3O4、Al2O3发生反应变为Fe2+、Fe3+、Al3+存在于溶液中;而SiO2不能溶解在酸中,被过滤除去;
(2)由于Fe3+、Al3+形成沉淀时的溶液的pH接近,不容易分离,所以加入Fe粉除调pH外,另一个作用是将溶液中Fe3+还原为Fe2+,便于与Al3+分离;由于Al3+沉淀完全的溶液的pH=4.7,而Fe2+沉淀完全的溶液的pH=9.7,所以Fe粉调节溶液的pH为4.7~7.6或其之间的任意数值;
(3)根据题意在“沉淀、过滤”步骤中生成FeCO3的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;由于在过程中加入的是硫酸和NH4HCO3,所以所得滤液的主要溶质是(NH4)2SO4;
(4)高温条件下,FeCO3和O2发生反应产生Fe2O3和CO2,根据电子守恒和元素的原子个数守恒可得该“氧化”步骤中发生反应的化学方程式为FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案