题目内容
|
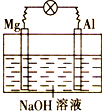
将镁片、铝片平行插入到一定浓度的 NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是 | |
| [ ] | |
A. |
镁比铝活泼,镁失去电子被氧化成 Mg2+ |
B. |
铝是电池负极,开始工作时溶液中会立即有白色沉淀生成 |
C. |
该装置的内、外电路中,均是电子的定向移动形成电流 |
D. |
该装置开始工作时,铝片表面的氧化膜可不必处理 |
答案:D
解析:
解析:
|
讲析:在 NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,由于铝片表面的氧化膜也能与NaOH溶液反应,故其不必处理;由于电池开始工作时,生成的铝离子的量较少,相对的NaOH过量,此时不会有Al(OH)3白色沉淀生成;该装置外电路,是由电子的定向移动形成电流,而内电路,则是由溶液中自由移动的离子的定向移动形成电流.故答案为D选项.点拨:判断电极种类的基本依据是:阳极 (原电池为负极):失电子→发生氧化反应;阴极(原电池为正极):得电子→发生还原反应. |

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是
| A.镁比铝活泼,镁失去电子被氧化成Mg2+ |
| B.该装置开始工作时,铝片表面的氧化膜可不必处理 |
| C.该装置的内、外电路中,均是电子的定向移动形成电流 |
| D.铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成 |
 将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )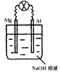 A. 镁比铝活泼,镁失去电子被氧化成Mg2+
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
