题目内容
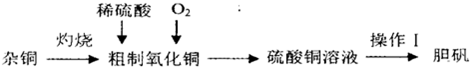
硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:

(1)操作Ⅰ具体为 、 、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是 (填字母代号)。
A.灼烧过程中部分氧化铜被还原
B.灼烧不充分,铜未被完全氧化
C.氧化铜在加热过程中分解生成铜
D.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量 (填化学式,下同),调节pH=4,生成 沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
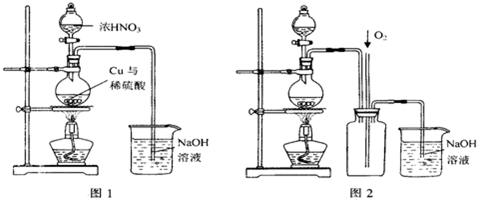
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2 NaNO3+NaNO2+H2O)。
NaNO3+NaNO2+H2O)。
 ??????????????????
?????????????????? 
????????? 图1????????????????????????????????????????????????????????? 图2
烧瓶内发生反应的离子方程式为 ;
图2是图1的改进装置,其优点有:① ;② 。
(1)蒸发浓缩 冷却结晶
(2)AB
(3)CuO(其他合理答案也可) Fe(OH)3
(4)Cu+4H++2N
 Cu2++2NO2↑+2H2O
Cu2++2NO2↑+2H2O
3Cu+8H++2N
 3Cu2++2NO↑+4H2O(写出一个即可) ①防止氢氧化钠溶液倒吸进入发生装置 ②NO、NO2气体被完全吸收
3Cu2++2NO↑+4H2O(写出一个即可) ①防止氢氧化钠溶液倒吸进入发生装置 ②NO、NO2气体被完全吸收
【解析】(2)注意信息“含少量有机物”,有机物一般具有还原性,所以A选项也有可能;(3)为了不引入新的杂质,依据信息结合Fe3++3H2O Fe(OH)3+3H+,可知加入CuO、Cu(OH)2等均能使溶液中H+减小,生成Fe(OH)3沉淀
Fe(OH)3+3H+,可知加入CuO、Cu(OH)2等均能使溶液中H+减小,生成Fe(OH)3沉淀