题目内容
如图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体c呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是:( )


答案:B、D
解析:
解析:
|
选项D是因为盐酸很容易与氨气发生反应生成溶于水的氯化铵,可使烧瓶内的压强急剧降低,形成喷泉.氢氧化钠溶液可以大量吸收二氧化碳形成易溶的碳酸盐,选项B也可以形成喷泉.选项A不是正确答案,3NO2+H2O |

练习册系列答案
相关题目
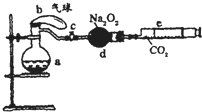 (2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占
(2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占 (2011?杭州一模)氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:
(2011?杭州一模)氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:


