题目内容
下列电子排布图能表示氮原子的最低能量状态的是( )
A. | B. |
C. | D. |
C
解析试题分析:A、2p轨道上的3个电子应分别占据1个轨道,不符合洪特规则,错误;B、2p轨道上的3个电子的自旋方向不同,不符合洪特规则,错误;C、符合基态原子电子排布的能量最低原理、洪特规则,正确;D、2p轨道上失去1个电子,不是氮原子的排布图,错误,答案选C。
考点:考查原子结构中基态原子的电子排布

练习册系列答案
相关题目
元素周期律和元素周期表是学习化学的重要工具,下列叙述不正确的是( )
| A.从左到右,元素周期表中的第13列为ⅢA族 |
| B.某ⅡA族元素的原子序数为x ,则与它同周期的ⅢA族元素的原子序数可能为x+25 |
| C.ⅥA族元素,随原子半径增大,对应气态氢化物的稳定性逐渐增强 |
| D.53号元素位于周期表P区、第五周期ⅦA族。 |
已知33As、35Br位于同一周期。下列关系正确的是
| A.原子半径:As>Cl>P |
| B.热稳定性:HCl>AsH3>HBr |
| C.还原性:As3->S2->Cl- |
| D.酸性:H3AsO4>H2SO4>H3PO4 |
对于原子核外电子以及电子的运动,下列描述正确的是( )。
①可以测定某一时刻电子所处的位置
②电子质量很小且带负电荷
③运动的空间范围很小
④高速运动
⑤有固定的运动轨道
⑥电子的质量约为质子质量的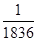
| A.①②③ | B.②③④⑥ | C.③④⑤⑥ | D.⑤⑥ |
元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子排布。下列推测不正确的是( )。
| A.同周期元素中X的金属性最强 |
| B.原子半径:X>Y,离子半径:X+>Z2- |
| C.同族元素中Z的氢化物稳定性最高 |
| D.同周期元素中Y的最高价含氧酸的酸性最强 |
下列说法中正确的是( )。
| A.在周期表中金属与非金属的分界处可以找半导体材料 |
| B.H2S、H2Se、HF的热稳定性依次增强 |
| C.NaOH、KOH、Mg(OH)2的碱性依次减弱 |
| D.Cl、S、N元素的非金属性依次增强 |
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
A.等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
据科学家预测,月球的土壤中吸附着数百万吨的 He,每百吨
He,每百吨 He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以 He的形式存在。下列说法正确的是( )。
He的形式存在。下列说法正确的是( )。
A. He原子核内含有4个质子 He原子核内含有4个质子 |
B. He和 He和 He互为同位素 He互为同位素 |
C. He原子核内含有3个中子 He原子核内含有3个中子 |
D. He的最外层电子数为2,所以 He的最外层电子数为2,所以 He具有较强的金属性 He具有较强的金属性 |
下列关于化学观或化学研究方法的叙述中,错误的是( )
| A.在化工生产中应遵循“绿色化学”的思想 |
| B.在过渡元素中寻找优良的催化剂 |
| C.在元素周期表的金属和非金属分界线附近寻找半导体材料 |
| D.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |