题目内容
实验室可用NaBr、浓硫酸、乙醇为原料制备溴乙
烷,已知反应物的用量:0.3molNaBr(s);0.25mol
C2H5OH(乙醇);36mL浓硫酸(溶质分数为98%,密
度1.84g/cm3);25mLH2O,其中乙醇的密度为
0.80g/cm3,回答下列问题:
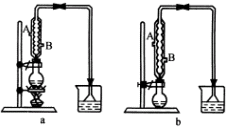
(1)该实验应选择图中的a还是b装置?__________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
[ ]
|
A.50mL |
B.100mL |
|
C.150mL |
D.250mL |
(3)冷凝管中的冷凝水的流向应是________
|
A.A进B出 |
B.B进A出 |
|
C.从A进或B进均可 |
(4)由NaBr、浓硫酸和乙醇共热制备C2H5Br反应的化学方程式为________;
可能发生的副反应为:________。
(5)上述反应完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是________,必须使用的仪器是________。
(7)本实验的产率为60%,则可制取溴乙烷________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是________。
答案:
解析:
解析:
|
(1)a装置 (2)C (3)B (4)
副反应: H2SO4+2HBr=Br2+SO2↑+2H2O (5)C2H5Br;C2H5OC2H5(乙醚); (6)NaOH溶液;分液漏斗; (7)16.35 (8)将溴乙烷与NaOH溶液共热反应完全后,加入稀HNO3酸化,再加入AgNO3溶液,若生成淡黄色沉淀,则证明溴乙烷中含溴元素。 |

练习册系列答案
相关题目
 实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:

 C2H5Br+H2O
C2H5Br+H2O