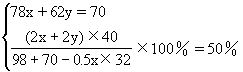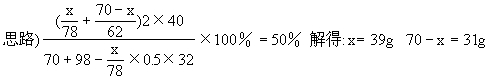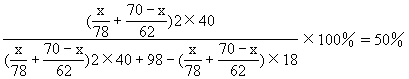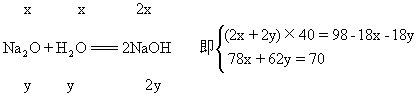题目内容
将70g过氧化钠和氧化钠的混合物跟98g水充分反应后,所得氢氧化钠溶液的质量分数为50%。试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算原混合物中过氧化钠和氧化钠的质量各为多少克?
答案:
解析:
提示:
解析:
| 2Na2O2+2H2O===4NaOH+O2↑
Na2O+H2O===2NaOH
解法一 设混合物中含xmolNa2O2和ymol
Na2O 解得:x=0.50mol Na2O2质量为0.50×78=39g y=0.50mol Na2O质量为0.50×62=31g 解法二 设混合物中Na2O2质量xg
Na2O质量为(70-x)g(同上解法 解得:x=39g 70-x=31g 解法四 设混合物中含xmol Na2O2,ymol Na2O 根据题意,反应后所得NaOH溶液的质量分数50%,也就是说NaOH和H2O的质量相等,得 2Na2O2+2H2O===4NaOH+O2↑ 解得x=0.5mol Na2O2为78×0.50=39(g) y=0.5mol Na2O2为62×0.50=31(g) Na2O2、Na2O质量分别为39g、31g
|
提示:
| 这是一道结合钠的氧化物的性质与溶液浓度联系,并通过化学方程式进行的混合物量的关系的计算。
|

练习册系列答案
相关题目