题目内容
17.将8.4g 的CO2和H2O混合气体,通入足量的Na2O2中,可得O2(标准状况)2.8L,求原混合气体中CO2与H2O的物质的量.分析 发生的反应有:2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2,设出二氧化碳、水的物质的量,然后分别根据混合物总质量、生成气体的量列式计算.
解答 解:设混合物中含有xmol二氧化碳、ymol水,
根据混合物总质量可得:①44x+18y=8.4,
根据反应2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2可知,生成氧气的物质的量为:②$\frac{1}{2}$(x+y)=$\frac{2.8L}{22.4L/mol}$=0.125,
联立①②解得:x=0.15、y=0.1,
答:原混合气体中CO2与H2O的物质的量分别为0.15mol、0.1mol.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生化学计算能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
8.下列说法正确的是( )
| A. | 将明矾加入海水中静置过滤是海水淡化的方法之一 | |
| B. | 海水晒盐的过程发生复分解反应 | |
| C. | 海水中提取镁的过程不涉及氧化还原反应 | |
| D. | 从海水中提取铀等微量元素是海水资源综合利用研究方向之一 |
9.下列说法中正确的是( )
| A. | HCl中存在离子键,属于离子化合物 | |
| B. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| C. | 阴阳离子通过静电引力而形成的化学键称为离子键 | |
| D. | 非金属元素组成的化合物中只含共价键 |
12.设NA为阿伏伽德罗常数,下列关于1L0.2mol•L-1的Ba(NO3)2溶液正确的说法是( )
| A. | 2L溶液中阴阳离子总数为0.8NA | |
| B. | 500mL溶液中的Ba2+离子浓度为0.2mol•L-1 | |
| C. | 500mL溶液中的NO3-离子总数为0.2NA | |
| D. | 500mL溶液中的NO3-浓度为0.2mol•L-1 |
2.在一密闭容器中,反应mA(g)+nB(s)?3C(g)达到平衡时,测得C(A)为0.5mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得C(A)为0.3mol/L,则下列判断不正确的是( )
| A. | 混合气体密度一定减小 | B. | 平衡一定向逆反应方向移动 | ||
| C. | 化学计量数:m+n<3 | D. | 物质C的体积分数减小了 |
6.25℃时,在0.01 mol•L-1的硫酸溶液中,水电离出的H+浓度是( )
| A. | 5×10-13 mol•L-1 | B. | 0.02 mol•L-1 | ||
| C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
7.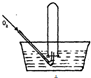 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )| A. | 49mL | B. | 28 mL | C. | 30mL | D. | 24.5mL |
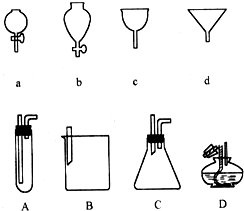 如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.
如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.