题目内容
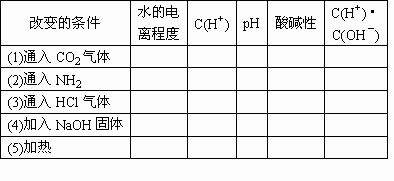
25℃时水中存在如下平衡:H2O![]() H++OH-若改变外界条件,水中的C(H+)、pH、酸碱性、水的电离程度及C(H+)与C(OH-)的乘积将发生什么变化?用增大(强)、减小(弱)、不变、酸性、碱性等将结果填入下表:
H++OH-若改变外界条件,水中的C(H+)、pH、酸碱性、水的电离程度及C(H+)与C(OH-)的乘积将发生什么变化?用增大(强)、减小(弱)、不变、酸性、碱性等将结果填入下表:
答案:

练习册系列答案
相关题目
中学常用淡黄色的pH试纸测定溶液的酸碱性。在25℃时,若溶液的pH=7,试纸不变色;若pH< 7 ,试纸变红色;若pH > 7,试纸变蓝色。
⑴已知水中存在如下平衡: H2O + H2O  H3O+ + OH-。现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是
H3O+ + OH-。现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是
| A.向水中加入NaHSO4 | B.向水中加入Cu(NO3)2 | C.加热至100℃ | D.向水中加入(NH4)2SO4 |
⑶纯碱因水溶液显碱性而得名。请用离子方程式表示显碱性的原因:
。
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡:
H2O+H2O H3O++OH- ΔH>0
H3O++OH- ΔH>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母).
| A.向水中加入NaHSO4 |
| B.向水中加入Na2CO3 |
| C.加热水至100℃[其中c(H+)=1×10-6 mol/L] |
| D.在水中加入(NH4)2SO4 |
 H3O+ +
OH-。现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是
H3O+ +
OH-。现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是