题目内容
在200 mL 含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5 mol·L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是( )
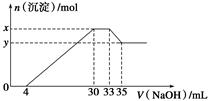

| A.x-y=0.01 mol |
| B.原溶液中c(Cl-)=0.75 mol·L-1 |
| C.原溶液的pH=1 |
| D.原溶液中n(Mg2+)∶n(Al3+)=5∶1 |
B
依次发生的反应为H++OH-=H2O,Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,NH4++OH-=NH3·H2O,Al(OH)3+OH-=AlO2-+2H2O;n[Al(OH)3]=0.002 L×5 mol·L-1=0.01 mol
n[Mg(OH)2]= =0.05 mol
=0.05 mol
A项,x-y=0.01 mol,正确;
B项,根据电荷守恒得:
3c(Al3+)+2c(Mg2+)+c(NH4+)+c(H+)=c(Cl-)+c(OH-)[注:c(OH-)可忽略不计]
n(Cl-)=0.01 mol×3+0.05 mol×2+0.003 L×5 mol·L-1+0.004 L×5 mol·L-1=
0.165 mol
c(Cl-)= =0.825 mol·L-1,错误;
=0.825 mol·L-1,错误;
C项,c(H+)= =0.1 mol·L-1
=0.1 mol·L-1
pH=1,正确;D项, =
= =5,正确。
=5,正确。
n[Mg(OH)2]=
 =0.05 mol
=0.05 molA项,x-y=0.01 mol,正确;
B项,根据电荷守恒得:
3c(Al3+)+2c(Mg2+)+c(NH4+)+c(H+)=c(Cl-)+c(OH-)[注:c(OH-)可忽略不计]
n(Cl-)=0.01 mol×3+0.05 mol×2+0.003 L×5 mol·L-1+0.004 L×5 mol·L-1=
0.165 mol
c(Cl-)=
 =0.825 mol·L-1,错误;
=0.825 mol·L-1,错误;C项,c(H+)=
 =0.1 mol·L-1
=0.1 mol·L-1pH=1,正确;D项,
 =
= =5,正确。
=5,正确。
练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目



 Cu2++SO2↑+2H2O
Cu2++SO2↑+2H2O