题目内容
【题目】SO2、NOx的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2,催化还原SO2不仅可以消除SO2污染,而且可以得到有价值的中单质硫,采取氨水吸收NOx的方法去除NOx的污染,生成硝酸按。
(1)已知CH4和S的燃烧热分别为a kJ/mol和bkJ/mol。在复合组分催化剂作用下,甲烷可使SO2转化为S,同时生成CO2和液态水,该反应的热化方程式为___________。
(2)用H2还原SO2生成S的反应分两步完成,如图甲所示,该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示:
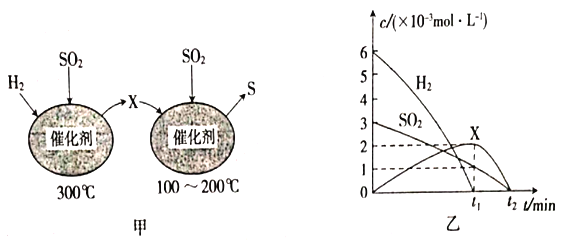
分析可知X为____________(写化学式);0-t1时间段的反应温度为____________,0-t1时间段用SO2表示的化学反应速率为______________________。
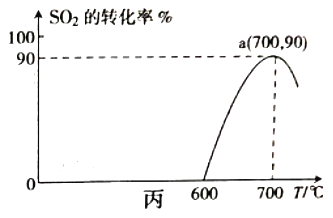
(3)焦炭催化还原SO2生成S2的化学方程式为 2C(s)+2SO2 (g)=S2(g)+2CO2(g)。在恒容容器中,浓度为1mol/L的SO2与足量焦炭反应,SO2的转化率随温度的变化如图丙所示。700℃时该反应的平衡常数为____________。
(4)25℃时,用1mol/L的Na2SO3溶液吸收SO2,当溶液的pH=7时,溶液中各离子浓度的大小关系为_____________。(已知:H2SO3的电离常数Ka1=1.3×10-2,Ka2=6.2×10-8)
(5)利用双离子交换膜电解法可以从含硝酸铵的工业废水里生产硝酸和氨。阳极室得到的物质是______,写出阳极反应方程式_______________________;阴极室得到的物质是_____________,写出阴极反应及获得相应物质的方程式______________、________________。
【答案】CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H=+(2b-a)kJ/mol H2S 300℃ ![]() mol/(L·min) 36.45 c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-) 硝酸 2H2O-4e-=4H++O2↑或4OH--4e-=2H2O+O2↑ 氨 2H2O+2e-=H2↑+2OH-或 2H++2e-=H2↑ NH4++OH-=NH3+H2O或 NH4++OH-=NH3·H2O
mol/(L·min) 36.45 c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-) 硝酸 2H2O-4e-=4H++O2↑或4OH--4e-=2H2O+O2↑ 氨 2H2O+2e-=H2↑+2OH-或 2H++2e-=H2↑ NH4++OH-=NH3+H2O或 NH4++OH-=NH3·H2O
【解析】
(1)先写出CH4和S的燃烧热的热化学方程式,然后将两个热化学方程式叠加,可得需求的热化学方程式。
(2)根据氧化还原反应原理分析;0-t1时间段,X的浓度达到最大,应是图1左侧反应,方程式为3H2+SO2=H2S+2H2O,温度为300℃;根据v=![]() 计算;
计算;
(3)a点为700℃时SO2的转化率为90%,根据平衡常数的含义计算。
(4)当吸收液呈中性时溶质为亚硫酸钠和亚硫酸氢钠,根据电离水解能力和电荷守恒分析;
(5)从含硝酸铵的工业废水里生产硝酸和氨,则为硝酸铵中NO3-与H+结合生成硝酸,NH4+与OH-结合生成氨,实际在电解水,阳极为水电离产生的OH-失去电子发生氧化反应,阴极为水电离产生的H+得到电子发生还原反应,据此可得。
(1)已知CH4和S的燃烧热分别为akJ/mol和bkJ/mol,可知热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=akJ/mol
②S(s)+O2(g)=SO2(g) △H=bkJ/mol
由盖斯定律①-②×2可得CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H=+(2b-a)kJ/mol;
(2)图1右图SO2→S,S元素的化合价降低,根据氧化还原反应特点,化合价有升高,必然有降低,因此推出X为H2S;0-t1时间段,X的浓度达到最大,应是图1左侧反应,方程式为3H2+SO2=H2S+2H2O,温度为300℃;根据化学反应速率的表达式,v(SO2)=![]() =
=![]() mol/(L·min);
mol/(L·min);
(3)由图可知,a点为700℃时SO2的转化率为90%,则根据方程式2C(s)+2SO2(g)=S2(g)+2CO2(g)中物质的转化关系可知平衡时各种物质的浓度c(SO2)=0.1mol/L,c(S2)=0.45mol/L,c(CO2)=0.9mol/L,所以700℃时该反应的平衡常数K=![]() =36.45 mol/L;
=36.45 mol/L;
(4)已知:H2SO3的电离常数Ka1=1.![]() =
=![]() ,亚硫酸氢钠的电离常数为6.2×10-8,小于亚硫酸钠的水解平衡常数,当吸收液呈中性时溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,呈中性时,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中氢离子浓度等于氢氧根离子浓度,溶液中阴阳离子所带电荷相等,则c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-);
,亚硫酸氢钠的电离常数为6.2×10-8,小于亚硫酸钠的水解平衡常数,当吸收液呈中性时溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,呈中性时,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中氢离子浓度等于氢氧根离子浓度,溶液中阴阳离子所带电荷相等,则c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-);
(5)从含NH4NO3的工业废水里生产硝酸和氨,则为硝酸铵中NO3-与H+结合生成硝酸,NH4+与OH-结合生成氨,实际在电解水,则阳极为水失去电子发生氧化反应为:2H2O-4e-=4H++O2↑或4OH--4e-=2H2O+O2↑,NO3-与H+结合生成硝酸;阴极为水得到电子发生还原反应:2H2O+2e-=H2↑+2OH-或 2H++2e-=H2↑,NH4+与OH-结合生成氨。

 阅读快车系列答案
阅读快车系列答案