题目内容
10.下列有关元素的性质及其递变规律正确的是( )| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | ⅠA和ⅦA族元素间可形成离子化合物和共价化合物 | |
| C. | 同主族元素的简单阴离子还原性越强,元素非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其金属性越强 |
分析 A.主族元素族序数与其最高正化合价相等,但O、F元素没有正化合价;
B.第IA族和第VIIA族元素可能形成离子键化合物或共价化合物;
C.同一主族元素的简单阴离子还原性越强,该非金属元素非金属性越弱;
D.同一周期金属元素的化合价越高,其金属性越弱.
解答 解:A.主族元素族序数与其最高正化合价相等,因为O、F元素电负性较大,导致O、F元素没有正化合价,故A错误;
B.第IA族和第VIIA族元素可能形成离子键化合物或共价化合物,如HCl、NaCl等,故B正确;
C.同一主族元素的简单阴离子还原性越强,该非金属元素得电子能力越弱,所以其非金属性越弱,故C错误;
D.主族元素族序数与其最高正化合价相等,同一周期金属元素的化合价越高,其原子序数越大,则金属性越弱,故D错误;
故选B.
点评 本题考查同一周期同一主族元素性质递变规律,侧重考查元素周期律知识,明确元素周期律内涵是解本题关键,注意规律中的异常现象,异常现象是A.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大.回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如图:

已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如下表:
(1)加入NaOH溶液调节pH=8.0,目的是使Fe3+、Zn2+完全沉淀而除去;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=1.0×10-17.
(2)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(4)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(5)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液的总反应方程式为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑.

已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(2)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(4)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(5)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液的总反应方程式为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑.
5.下列说法正确的是( )
| A. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C是碳元素的三种核素 | |
| B. | SO2分子中含有离子键 | |
| C. | MgCl2固体中含有共价键 | |
| D. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同的中子数 |
15.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为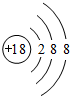 ;最活泼的非金属元素的离子结构示意图
;最活泼的非金属元素的离子结构示意图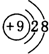 ;最活泼金属元素过氧化物的电子式
;最活泼金属元素过氧化物的电子式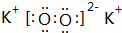 ,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
(2)写出⑤与⑦两元素最高价氧化物对应水化物反应的化学方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)设计实验方案:比较③与⑧单质氧化性的强弱,请将方案填入下表.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
 ;最活泼的非金属元素的离子结构示意图
;最活泼的非金属元素的离子结构示意图 ;最活泼金属元素过氧化物的电子式
;最活泼金属元素过氧化物的电子式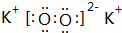 ,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.(2)写出⑤与⑦两元素最高价氧化物对应水化物反应的化学方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)设计实验方案:比较③与⑧单质氧化性的强弱,请将方案填入下表.
| 实验步骤 | 实验现象与结论 |
| 向H2S溶液中通入O2 | 溶液出现浑浊,说明O2的氧化性比S强 |
2.下列基态原子或离子的电子排布式错误的是( )
| A. | K 1s22s22p63s23p64s1 | B. | Mg2+ 1s22s22p6 | ||
| C. | F- 1s22s22p5 | D. | Br 1s22s22p63s23p63d104s24p5 |
19.与溴水、酸性高锰酸钾溶液、氢氧化铜悬浊液、碳酸氢钠都能反应的是( )
| A. | CH3CH2CHO | B. | 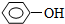 | C. | CH2=CH2 | D. | HOOCCH=CH2 |
20.下列粒子中,与K+含有相同电子数的是( )
| A. | F- | B. | Cl- | C. | Br- | D. | I- |

 .
.