题目内容
9.下列变化不能直接实现的是( )A( HCl)→B(Cl2)→C(Ca(ClO)2)→D(HClO)→E(CO2)
| A. | A→B | B. | B→C | C. | C→D | D. | D→E |
分析 浓盐酸可与二氧化锰在加热条件下反应生成Cl2,Cl2可与石灰乳反应生成Ca(ClO)2,Ca(ClO)2与酸反应可生成HClO,注意HClO的酸性比碳酸弱的特点,以此解答.
解答 解:A.浓HCl与二氧化锰在加热的条件下能产生Cl2,可直接实现HCl至Cl2的转化,故A正确;
B.Cl2与氢氧化钙反应生成CaCl2、Ca(ClO)2和H2O,可直接实现Cl2至Ca(ClO)2的转化,故B正确;
C.Ca(ClO)2能与H2O和二氧化碳反应生成碳酸钙和次氯酸(HClO),可直接实现Ca(ClO)2至HClO的转化,故C正确;
D.因HClO的酸性弱于碳酸,所以不能直接实现HClO至CO2的转化,故D错误.
故选D.
点评 本题考查含氯化合物的性质,为高频考点,熟练掌握常见物质的性质及变化规律,是解答此类问题的知识基础,明确“直接实现”的意义则是解答问题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列指定微粒的个数比为2:1的是( )
| A. | Be2+离子中的质子和电子 | B. | H原子中的中子和质子 | ||
| C. | NaHCO3晶体中的阳离子和阴离子 | D. | Na2O2固体中的阴离子和阳离子 |
4.碱式碳酸铜和氯气都是用途广泛的化工原料.
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
①氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;
②反应A后调节溶液的pH范围应为3.2-4.2.
③第一次过滤得到的产品洗涤时,如何判断已经洗净?取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净.
④造成蓝绿色产品中混有CuO杂质的原因是反应B的温度过高.
(2)已知在某温度下Fe(OH)3的容度积常数Ksp=[Fe(OH)3]=1.0×10-38,已知在该温度下溶液中Fe3+离子浓度小于1×10-5mol/L时,该离子已沉淀完全.则该沉淀完全所需要的pH为3.3.
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
②反应A后调节溶液的pH范围应为3.2-4.2.
③第一次过滤得到的产品洗涤时,如何判断已经洗净?取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净.
④造成蓝绿色产品中混有CuO杂质的原因是反应B的温度过高.
(2)已知在某温度下Fe(OH)3的容度积常数Ksp=[Fe(OH)3]=1.0×10-38,已知在该温度下溶液中Fe3+离子浓度小于1×10-5mol/L时,该离子已沉淀完全.则该沉淀完全所需要的pH为3.3.
14.向碳酸钠溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液中HCO3-浓度的变化趋势可能是( )
| A. | 逐渐减小 | B. | 逐渐增大 | ||
| C. | 先逐渐增大,后逐渐减小 | D. | 先逐渐减小,后逐渐增大 |
1.在等温、等容条件下,有下列气体反应:2A(g)+2B(g)?C(g)+3D(g).现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2mol/L和6mol/L.下列叙述正确的是( )
| A. | 达到平衡时,Ⅰ途径的反应速率V(A)等于Ⅱ途径的反应速率V(A) | |
| B. | 达到平衡时,第Ⅰ条途径混合气体的密度与第Ⅱ条途径混合气体的密度相同 | |
| C. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同 | |
| D. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数不同 |
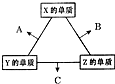 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.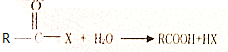
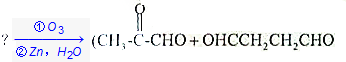

 .
.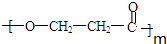 +(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应.
+(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应. ,反应中NaH作为还原剂.
,反应中NaH作为还原剂.