题目内容
15.碘缺乏症遍及全球,多发生在山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病区.我国云南、河南等10余省的山区发病率也较高.据估计我国患者约有1000万人左右,为控制该病的发生,较为有效的方法是食用含碘食盐.我国府以国家际准的方式规定在食盐中加碘(KIO)据此回答下列问题.(1)可用盐酸酸化的碘化钾钾和淀粉检验食盐中的碘酸钾,反应的化学方程式为5KI+KIO3+6HCl=6KCl+3H2O+3I2氧化产物与还原产物的物质的量之比为5:1能观察到的明显现象是溶液变蓝色.
(2)用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-,可供选择的物质有①自来水; ②蓝色石蕊试纸; ③淀粉-KI试纸;④淀粉;⑤白糖;⑥食醋;⑦白酒.进行上述实验时必须使用的物质是B(填字母序号).
A、①③B、③⑥C、②④⑥D、①②④⑤⑦
分析 (1)碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘,碘遇淀粉变蓝色,据此分析;
(2)IO3-+5I-+6H+═3I2+3H2O根据此反应方程式知,该反应需要酸性条件,需要碘离子,需要淀粉碘化钾试纸检验,据此判断选项;
解答 解:(1)碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;
该反应中KI是还原剂,还原剂对应的产物是氧化产物,KIO3是氧化剂,氧化剂对应的产物是还原产物,所以氧化产物、还原产物都是碘,物质的量之比为 5:1;
该反应中有碘单质生成,碘遇淀粉变蓝色,所以观察到溶液变蓝色.
故答案为:5KI+KIO3+6HCl=6KCl+3H2O+3I2; 5:1; 溶液变蓝色.
依题意:IO3-+5I-+6H+=3I2+3H2O;结合I2的特性----遇淀粉变蓝,要检验食盐中存在IO3-,
只需I-和酸溶液(即H+),生成的I2由淀粉检验,故选B.
点评 本题考查了物质的检验,氧化还原反应的概念分析,电子转移的计算应用,难度不大,会根据题中信息及物质的特殊性质选取试剂.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列反应的离子方程式,书写正确的是( )
| A. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| B. | H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| D. | 氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ |
10.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si.
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si.
| A. | 只有① | B. | ①③⑤ | C. | ②④⑤⑥ | D. | ①③ |
20.铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
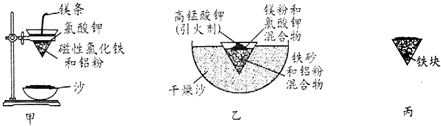
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称)进行实验,所发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
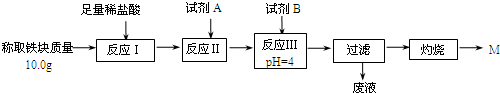
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=1.1×10-6mol•L-1.
③灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”)原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称)进行实验,所发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=1.1×10-6mol•L-1.
③灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”)原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
7.下列说法不正确的是( )
| A. | Al2O3用作耐火材料、Al(OH)3用作阻燃剂 | |
| B. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| C. | 碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 | |
| D. | 盛放NaOH溶液的磨口玻璃瓶要用橡胶塞 |
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题 A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题
A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题