��Ŀ����
�״�ȼ�Ϸ�Ϊ�״����ͺͼ״����͡���ҵ�Ϻϳɼ״��ķ����ܶࡣ
��1��һ�������·�����Ӧ��
��CO2��g�� +3H2��g�� ��CH3OH��g��+H2O��g�� ��H1
��2CO��g�� +O2��g�� ��2CO2��g�� ��H2
��2H2��g��+O2��g�� ��2H2O��g�� ��H3
��CO��g�� + 2H2��g��  CH3OH��g�����ġ�H�� ��
CH3OH��g�����ġ�H�� ��
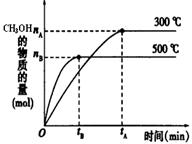
��2�����ݻ�Ϊ2L���ܱ������н��з�Ӧ�� CO��g��+2H2��g�� CH3OH��g�� �������������䣬��300���500��ʱ�����ʵ���n��CH3OH�� �뷴Ӧʱ��t�ı仯������ͼ��ʾ���÷�Ӧ�ġ�H 0 ����>��<��=����
CH3OH��g�� �������������䣬��300���500��ʱ�����ʵ���n��CH3OH�� �뷴Ӧʱ��t�ı仯������ͼ��ʾ���÷�Ӧ�ġ�H 0 ����>��<��=����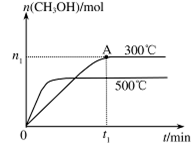
��3����Ҫ��״��IJ��ʣ��ɲ�ȡ�Ĵ�ʩ��____________������ĸ����
| A����������� |
| B�������¶� |
| C�������¶� |
| D��ʹ�ú��ʵĴ��� |
��4��CH4��H2O�ڴ������淢����ӦCH4+H2O
 CO+3H2��T��ʱ����1 L�ܱ�������Ͷ��1 mol CH4��1 mol H2O��g����5Сʱ���÷�Ӧ��ϵ�ﵽƽ��״̬����ʱCH4��ת����Ϊ50% ��������¶��µ�ƽ�ⳣ�� ���������С�������λ���֣���
CO+3H2��T��ʱ����1 L�ܱ�������Ͷ��1 mol CH4��1 mol H2O��g����5Сʱ���÷�Ӧ��ϵ�ﵽƽ��״̬����ʱCH4��ת����Ϊ50% ��������¶��µ�ƽ�ⳣ�� ���������С�������λ���֣�����5���Լ״�Ϊȼ�ϵ����͵�أ���ɱ�����������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ���ش��������⣺
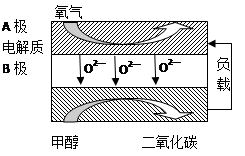
��B���ĵ缫��ӦʽΪ ��
�����ø�ȼ�ϵ������Դ����ʯī���缫�������ͭ��Һ������·��ת��1mole- ʱ��ʵ�������ĵļ״��������������ϴ���ԭ���� ��
��6��25��ʱ������Ƶ�Ksp=4.0��10-8,̼��Ƶ�Ksp=2.5��10-9����20ml̼��Ƶı�����Һ����μ���8.0��10-4 mol��L-1�IJ������Һ20ml���ܷ�������� ����ܡ�����
��1����H1+ ��H2 ��
��H2 �� ��H3
��H3
��2 ��
��3��ABE
��4��6.75
��5���� CH3OH + 3O2- -6e-= CO2+ 2H2O��
�ڼ״�����ȫ������������C��CO �� �������ת���ʴﲻ��100% ��6����
����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�̼��̼�Ļ�����㷺�Ĵ��������ǵ������С�
��1���������з�Ӧ�������仯ʾ��ͼ��2C(s) +O2(g) =2CO(g) ��H= ��
��2�������Ϊ2L���ܱ������У�����1 mol CO2��3mol H��һ�������·�����Ӧ�� CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H<O���CO2(g)��CH3OH(g)�����ʵ�����ʱ��仯��������ͼ��ʾ��
CH3OH(g)+H2O(g) ��H<O���CO2(g)��CH3OH(g)�����ʵ�����ʱ��仯��������ͼ��ʾ��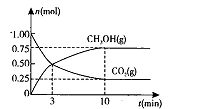
�ٴӷ�Ӧ��ʼ��ƽ�⣬H2O��ƽ����Ӧ����v(H2O)= ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����� �����ţ���
A�������¶� B����CH3OH��g����ʱҺ���Ƴ�
C��ѡ���Ч���� D���ٳ���l mol CO2��4 mol H2
��3��CO2����ˮ����̼�ᡣ��֪�������ݣ�
| ������� | H2CO3 | NH3��H2O |
| ����ƽ�ⳣ���� 25�棩 | Ka1 = 4��30 �� 10һ7 Ka2= 5��61�� 10һ11 | Kb = 1��77�� 10һ5 |
���г�����1 mol��L��1��( NH4)2CO3��Һ����֪��
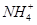 ˮ���ƽ�ⳣ��Kh=Kw/Kb��
ˮ���ƽ�ⳣ��Kh=Kw/Kb��
��һ��ˮ���ƽ�ⳣ��Kh=Kw/Ka2��
���жϸ���Һ�� ����ᡱ�����С��� ������ԣ�д������Һ��
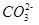 ������һ��ˮ������ӷ���ʽ ��
������һ��ˮ������ӷ���ʽ ������������֮��Ĺ�ϵʽ��������ȷ���� ��
A��
B��

C��
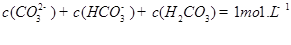
D��
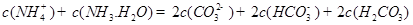
��4���ݱ�������ѧ����ʵ���������Ƴ���ȼ�ϵ�صķ�Ӧ�����У���������缫������CO��O2Ϊԭ�����ɵ�ء�ԭ����ͼ��ʾ��ͨ��CO�Ĺܿ��� ���c����d������д���õ缫�ĵ缫��Ӧʽ�� ��
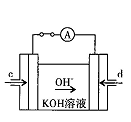
�����������������йط�Ӧ���ʱ䣺
��1����֪��Ti(s)��2Cl2(g)=TiCl4(l)��H����804��2 kJ��mol��1
2Na(s)��Cl2(g)=2NaCl(s)����H����882��0 kJ��mol��1
Na(s)=Na(l)����H����2��6 kJ��mol��1
��ӦTiCl4(l)��4Na(l)=Ti(s)��4NaCl(s)�Ħ�H��________ kJ��mol��1��
��2����֪���з�Ӧ��ֵ��
| ��Ӧ��� | ��ѧ��Ӧ | ��Ӧ�� |
| �� | Fe2O3(s)��3CO(g)= 2Fe(s)��3CO2(g) | ��H1����26��7 kJ��mol��1 |
| �� | 3Fe2O3(s)��CO(g)=2Fe3O4(s)��CO2(g) | ��H2����50��8 kJ��mol�� |
| �� | Fe3O4(s)��CO(g)=3FeO(s)��CO2(g) | ��H3����36��5 kJ��mol��1 |
| �� | FeO(s)��CO(g)=Fe(s)��CO2(g) | ��H4 |
��Ӧ�ܵĦ�H4��____________ kJ��mol��1��
���ǵ�ѭ�������е���Ҫ����,���ĺϳ���Ŀǰ�ձ�ʹ�õ��˹��̵�������
(1)����ͼ1�ṩ����Ϣ,д���÷�Ӧ���Ȼ�ѧ����ʽ:��������������������������������������������,��ͼ1��������������������(�a����b��)��ʾ��������ý�������仯���ߡ� 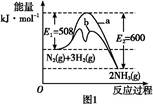
(2)�ں���������,������������˵��������Ӧ�Ѵ�ƽ���������������
A.3v(H2)��=2v(NH3)��
B.��λʱ��������n mol N2��ͬʱ����2n mol NH3
C.���������ܶȲ��ٸı�
D.������ѹǿ����ʱ��ı仯���仯
(3)һ���¶���,��2 L�ܱ������г���1 mol N2��3 mol H2,�����������,0.5 min��ﵽƽ��,�����������0.4 mol NH3,��ƽ����Ӧ����v(N2)=������������,���¶��µ�ƽ�ⳣ��K=�����������������������¶�,Kֵ�仯��������(���������С�����䡱)��
(4)Ϊ��Ѱ�Һϳ�NH3���¶Ⱥ�ѹǿ����������,ijͬѧ���������ʵ��,����ʵ�������Ѿ���������ʵ����Ʊ��С�
| ʵ���� | T(��) | n(N2)/n(H2) | p(MPa) |
| �� | 450 | 1/3 | 1 |
| �� | �� | �� | 10 |
| �� | 480 | �� | 10 |
A.�����ϱ��ո�������ʣ���ʵ���������ݡ�
B.���ݷ�ӦN2(g)+3H2(g)
 2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
�����꣬������ȾԽ��Խ���أ��������������ǵ�������С����彡�������������Ӱ�졣����β������Ҫ�Ĵ�����ȾԴ����������β��Σ���ķ���֮һ�����������ϰ�װ��ת�����������ķ�ӦΪ��

�� ,��H=__________kJ
,��H=__________kJ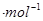 ���ú�a��b��c��d��ʽ�ӱ�ʾ����
���ú�a��b��c��d��ʽ�ӱ�ʾ����
��2��ij�¶��£����ݻ�Ϊ1L�������г���3 mol NO��1 mol CO, NO��ת������ʱ��ı仯����ͼ��ʾ��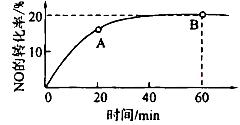
�ش��������⣺
�ٸ��¶��£���ѧƽ�ⳣ��K=___________��ƽ��ʱCO��ת����Ϊ__________��
��A����淴Ӧ������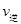 (CO)___________B����淴Ӧ����
(CO)___________B����淴Ӧ����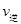 (NO)���>������<����=������
(NO)���>������<����=������
������ͼ����ȷ���ܱ�����ʱ��T1ʱ�̷�Ӧһ������ƽ��״̬����__________��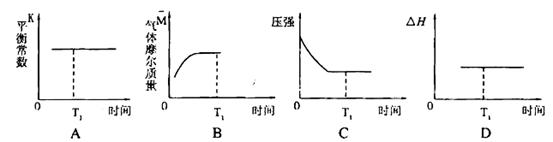
����÷�Ӧ��ƽ������¶ȣ�ƽ�ⳣ���������H___________0���>������< ����=����
�ܴ�ƽ����������ݻ�����һ��������˵����ȷ����
| A��ƽ��������Ӧ�����ƶ� | B��CO������������� |
| C��ƽ�ⳣ����С | D��һ����̼��Ũ������ |
ͭ���ʼ��仯�����ڹ�ҵ�����Ϳ���������Ҫ���á�
��1����֪��2Cu2O(s) + O2(g) = 4CuO(s)��H����292kJ��mol��1
2C(s)+O2(g)=2CO(g) ��H����221kJ��mol��1
��д��������̿�ۻ�ԭCuO��s���Ʊ�Cu2O��s�����Ȼ�ѧ����ʽ�� ��
��2�������Ȼ�ͭ����(CuCl2��2H2O�����Ȼ���������)��ȡ������CuCl2��2H2O���Ƚ����Ƴ�ˮ��Һ������ͼ��������ᴿ: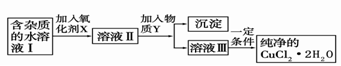
��֪Cu2+��Fe3+��Fe2+���������↑ʼ�����ͳ�����ȫʱ��pH���±�
| �������� | Fe3+ | Fe2+[��Դ:ѧ&��& | Cu2+ |
| �������↑ʼ����ʱ��pH | 1.9 | 7.0 | 4.7 |
| ����������ȫ����ʱ��pH | 3.2 | 9.0 | 6.7 |
��ش���������:
������������NaClO��H2O2��KMnO4��X�����ֺã�Ϊʲô��
�����������������������÷�Ӧ�����ӷ���ʽΪ ��
����ҺII�г�Cu2+�⣬���������������������ӣ���μ�������� ��
������Y����Ϊ���е�
a��CuO b��Cu(OH)2 c��CuCO3 d��Cu2(OH)2CO3 e��CaO f��NaOH
��������Һ���м���̼��ƣ�������������������������������������������
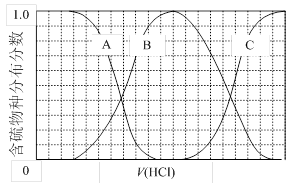
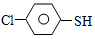 �����ȩ���Ȼ��������ʵ���֮��1:1:1��Ӧ���ɻ��һ��ɱ����м���X��H2O��
�����ȩ���Ȼ��������ʵ���֮��1:1:1��Ӧ���ɻ��һ��ɱ����м���X��H2O��
 CH3OH��g���ﵽ��ѧƽ��״̬��
CH3OH��g���ﵽ��ѧƽ��״̬��