题目内容
|
若锌与稀硝酸反应的化学反应方程式为4Zn+10HNO3 | |
A. |
4、1、5、N2O |
B. |
4、2、4、NO2 |
C. |
4、1、3、NH4NO3 |
D. |
4、3、5、NO |
答案:AC
解析:
解析:
|
讲析:很多同学习惯直接根据质量守恒定律求解.这种方法繁琐易错,同学们可以尝试结合质量守恒与电子得失守恒求解.本题分两种情况讨论: (1)物质M中的氮元素全部被还原.根据质量守恒定律得a=4(Zn守恒),故被还原的氮原子数为10-4×2=2(个).设M中氮元素的化合价为+n,由电子得失守恒有:4×2=2×(5-n),解得n=1,即M为N2O. (2)物质M中的氮元素部分被还原(如NH4NO3).a=4(Zn守恒),此时被还原的氮原子只有1个,且还原后的化合价为-3.反应中失电子总数为4×2e-=8e-,氮元素得电子总数为[5-(-3)]e-×1=8e-,二者相等,故M为NH4NO3也符合题意. 点拨:“好的方法是成功的一半”.在氧化还原反应的有关计算和判断中,首先要想到“守恒思想”,避免先书写、配平方程式,然后再根据化学计量数求解,另外要特别注意将电子守恒转化为元素化合价升降总数相等来解决问题. |

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重.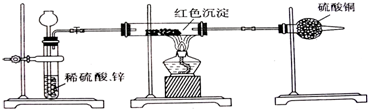
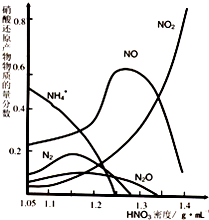 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.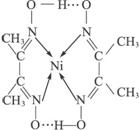 分子内的作用力有____________(填编号)。
分子内的作用力有____________(填编号)。
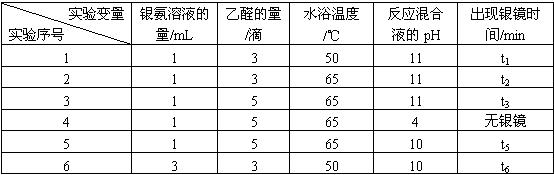 请回答下列问题:
请回答下列问题: