题目内容
3.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料.以含镍(Ni2+)废液为原料生产NiOOH的一种T艺流程如图1: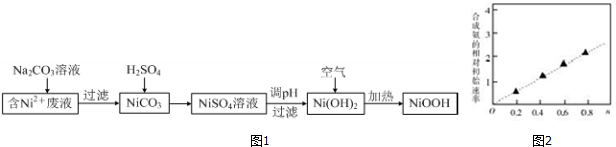
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成.过滤时需用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)写出碳酸镍与稀硫酸反应的离子方程式:NiCO3+2H+═Ni2++H2O+CO2↑.
(3)硫酸镍溶液可用于制备合成氨的催化剂C0Ni(1-n) Fe204.如图2表示在其他条件相同时合成氨的相对初始速率随催化剂中w值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(4)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O.
(5)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH•yNi(OH)2.现称取9.21g样品溶于稀硫酸,冷却后转入容量瓶并配制成500ml溶液,取出25.00mL,用0.010mol•L-1的KMnO4标准溶液滴定,用去KMnO4标准溶液10.00mL,则x:y=9:1.[已知反应(未配平):Ni2++MnO4-+H+→Ni3++Mn2++H2O].
分析 含镍(Ni2+)废液为原料生产NiOOH,在含Ni2+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入试剂调节溶液的pH使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH,
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,过滤用到的玻璃仪器有烧杯、漏斗、琉璃棒;
(2)碳酸镍与稀硫酸反应生成硫酸镍、二氧化碳、水,根据电荷守恒和元素守恒可写出反应的离子方程式;
(3)合成氨的相对初始速率随催化剂中n值增大而增大,而n增大,Co2+的比例增大;
(4)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水;
(5)消耗KMnO4物质的量:0.01 mol•L-1×0.01L=1×10-4mol,根据电子得失守恒可知Ni(OH)2的物质的量为5×10-4mol,可计算得混合物中Ni(OH)2的质量,再计算出NiOOH的质量,确定NiOOH的物质的量,依据xNiOOH•yNi(OH)2计算x和y的比值.
解答 解:含镍(Ni2+)废液为原料生产NiOOH,在含Ni2+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入试剂调节溶液的pH使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH,
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,具体操作步骤为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成,过滤用到的玻璃仪器有烧杯、漏斗、琉璃棒;
故答案为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;漏斗、琉璃棒;
(2)碳酸镍与稀硫酸反应生成硫酸镍、二氧化碳、水,反应的离子方程式为NiCO3+2H+=Ni2++H2O+CO2↑,
故答案为:NiCO3+2H+=Ni2++H2O+CO2↑;
(3)由图可知,随n值越大,合成氨的相对初始速率越大,而n增大,Co2+的比例增大,故Co2+的催化活性更高,
故答案为:Co2+;
(4)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水,原子守恒配平书写化学方程式为:4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O,
故答案为:4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O;
(5)Ni2++MnO4-+H+→Ni3++Mn2++H2O,根据电子得失守恒可知n(Ni2+):n(MnO4-)=5:1,消耗KMnO4物质的量为0.01 mol•L-1×0.01L=1×10-4 mol,n(Ni2+)=5×10-4mol,则Ni(OH)2的物质的量为5×10-4mol,所以样品中总Ni(OH)2的物质的量为5×10-4 mol×$\frac{500}{25}$=0.01mol,
n(NiOOH)=$\frac{9.21g-0.01mol×92.7g/mol}{91.7g/mol}$0.09 mol,
x:y=n(NiOOH):n[Ni(OH)2]=0.09 mol:0.01 mol=9:1,
故答案为:9:1.
点评 本题考查了物质分离方法和实验过程分析判断,侧重离子方程式的书写和氧化还原反应的计算应用,注意流程的理解,掌握实验基础和物质性质是关键,题目难度中等.

 室温条件下在醋酸和醋酸钠的混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol•L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )
室温条件下在醋酸和醋酸钠的混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol•L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )| A. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| B. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l | |
| D. | 表示CH3COO-浓度变化的是曲线Ⅰ |
| A. | CO2的球棍模型: | B. | 乙烷的结构式CH3-CH3 | ||
| C. | 新戊烷的结构简式:C(CH3)4 | D. | CCl4的电子式: |
| A. | 塑料 | B. | 纤维 | C. | 复合材料 | D. | 橡胶 |
| A. | 苯分子中C原子均以sp3杂化方式成键,形成夹角为120°的三个sp3杂化轨道,故为正六边形的碳环 | |
| B. | 每个碳原子还有一个未参与杂化的2p轨道,垂直碳环平面,相互交盖,形成大π键 | |
| C. | 大π键中6个电子被6个C原子共用,故称为6中心6电子大π键 | |
| D. | 苯分子中共有十二个原子共面,六个碳碳键完全相同 |
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式为2Na+2H2O═2NaOH+H2↑.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc.
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:XR>YX4
c.最高价氧化物对应的水化物的酸性:HRO4>H2YO3
(4)根据表中数据推测Y的原子半径的范围:0.099nm<rY<0.143nm.
(5)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙+水,则丙的化学式为NaAlO2(Na2SiO3或NaClO4)(写出一种即可).
 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 电池工作时,H+向石墨电极移动 | |
| B. | 石墨电极上反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 氧化银电极上反应为:Ag2O+2e-=2Ag+O2- | |
| D. | 该电池每转移4mol电子,石墨电极产生33.6 L CO2气体(标准状况) |
| A. | NH4NO3 | B. | AlCl3 | C. | Na2CO3 | D. | Al(OH)3 |
