题目内容
回收的废旧锌锰干电池经过处理后可得到锰粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤和数据如下:

(1)在加热条件下,用浓盐酸浸取锰粉得到含有Mn2+、Fe3+等离子的溶液,MnO2与浓盐酸反应的离子方程式 ,该处理方法的缺点 .
(2)步骤I中滤渣的化学式 ,步骤I中滤渣的化学式 .
(3)向步骤I的滤液中加足量H2O2的作用为 .再加NaOH溶液调节pH在3.7<pH<8.3,目的是 .
(4)向步骤II的滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,在这一过程中H2O2起 (填氧化剂、还原剂)的作用.

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(2)步骤I中滤渣的化学式
(3)向步骤I的滤液中加足量H2O2的作用为
(4)向步骤II的滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,在这一过程中H2O2起
考点:制备实验方案的设计,难溶电解质的溶解平衡及沉淀转化的本质,常见金属元素的单质及其化合物的综合应用,物质分离和提纯的方法和基本操作综合应用
专题:几种重要的金属及其化合物
分析:锰粉在浓盐酸中浸泡(为除去MnO2可加热),发生MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O、Mn(OH)2+2HCl=MnCl2+2H2O、Fe+2HCl=FeCl2+H2↑等反应,过滤后所得滤液中含有Mn2+、Fe2+、NH4+等离子,在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,并生成Fe(OH)3,控制溶液pH在3.7~8.3之间可除去Fe3+,过滤后所得滤液主要为Mn2+,滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,经过滤、洗涤、干燥可得MnO2,以此解答该题.
| ||
解答:
解:锰粉在浓盐酸中浸泡(为除去MnO2可加热),发生MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O、Mn(OH)2+2HCl=MnCl2+2H2O、Fe+2HCl=FeCl2+H2↑等反应,过滤后所得滤液中含有Mn2+、Fe2+、NH4+等离子,在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,并生成Fe(OH)3,控制溶液pH在3.7~8.3之间可除去Fe3+,过滤后所得滤液主要为Mn2+,滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,经过滤、洗涤、干燥可得MnO2,
(1)MnO2具有强氧化性,与浓盐酸反应生成氯气,反应的离子方程式为MnO2+4H++2C1-
Mn2++C12↑+2H2O,氯气有毒,不能直接排放到空气中,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;产生有毒的氯气;
(2)加入浓盐酸,只有炭黑不反应,可过滤分离,向滤液中加入足量H2O2溶液并加入NaOH溶液调节溶液PH后,可生成Fe(OH)3沉淀,故答案为:C;Fe(OH)3;
(3)在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,由表中数据可知,调节溶液PH在3.7<pH<8.3之间,可使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀,
故答案为:将Fe2+转化为Fe3+;使Fe3+完全沉淀,防止Mn2+转化为Mn(OH)2沉淀;
(4)过滤Ⅱ所得滤液中含有Mn2+,加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,
在这一过程中H2O2起氧化剂的作用,
故答案为:氧化剂.
| ||
(1)MnO2具有强氧化性,与浓盐酸反应生成氯气,反应的离子方程式为MnO2+4H++2C1-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)加入浓盐酸,只有炭黑不反应,可过滤分离,向滤液中加入足量H2O2溶液并加入NaOH溶液调节溶液PH后,可生成Fe(OH)3沉淀,故答案为:C;Fe(OH)3;
(3)在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,由表中数据可知,调节溶液PH在3.7<pH<8.3之间,可使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀,
故答案为:将Fe2+转化为Fe3+;使Fe3+完全沉淀,防止Mn2+转化为Mn(OH)2沉淀;
(4)过滤Ⅱ所得滤液中含有Mn2+,加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,
在这一过程中H2O2起氧化剂的作用,
故答案为:氧化剂.
点评:本题考查物质的制备和分离,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意根据物质的性质把握实验原理,本题易错点为(3).

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学式表示一种纯净物的是( )
| A、C |
| B、C4H8 |
| C、C2H6 |
| D、C2H4O2 |
乙烯是石油化工重要的原料之一,列举乙烯在化学工业的一种用途 .实验室制取乙烯用到的浓硫酸作 剂和 剂.乙烯可转化成乙醛,乙醛分子结构中的“ ”称为 基,实验室检验这一官能团通常用 (填一种试剂的名称).
”称为 基,实验室检验这一官能团通常用 (填一种试剂的名称).
 ”称为
”称为下列操作方法或实验装置正确的是( )
A、 探究NaHCO3的热稳定性 |
B、 NH3的收集 |
C、 向容量瓶中转移液体 |
D、 石油蒸馏 |
Na2O2中氧元素的化合价为( )
| A、+1 | B、0 | C、-1 | D、-2 |
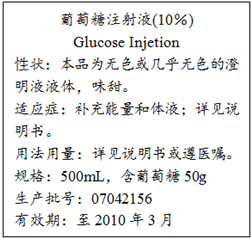 如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):
如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):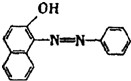 2005年4月10日,中央电视台发布“每周质量报告”,全国共有18个省市30家企业的88种食品样品中都检出了致癌物工业用染料“苏丹红I号”.苏丹红I号结构如图所示:
2005年4月10日,中央电视台发布“每周质量报告”,全国共有18个省市30家企业的88种食品样品中都检出了致癌物工业用染料“苏丹红I号”.苏丹红I号结构如图所示: