题目内容
下列说法中不正确的是( )
A、 在NaCl晶体中,距Na+最近的Cl-形成正八面体 |
B、 该气态团簇分子的分子式为E4F4或F4E4 |
C、 在SiO2晶体中,1molSi原子最多可形成4molSi-O键 |
D、 单质锌采取六方最密堆积,配位数为8 |
考点:金属晶体的基本堆积模型,原子晶体,金刚石、二氧化硅等原子晶体的结构与性质的关系
专题:化学键与晶体结构
分析:A.在氯化钠晶体中,钠离子的配位数是6,六个氯离子形成八面体;
B.分子晶体的构成微粒是分子,每个分子为一个整体;
C.在二氧化硅晶体中,每个Si原子能构成4个Si-O键;
D.锌为镁型堆积,其配位数是8.
B.分子晶体的构成微粒是分子,每个分子为一个整体;
C.在二氧化硅晶体中,每个Si原子能构成4个Si-O键;
D.锌为镁型堆积,其配位数是8.
解答:
解:A.在氯化钠晶体中,钠离子和氯离子的配位数都是6,六个氯离子形成八面体,故A正确;
B.分子晶体的构成微粒是分子,每个分子为一个整体,所以该分子的化学式为E4F4或F4E4,故B正确;
C.在二氧化硅晶体中,每个Si原子能构成4个Si-O键,所以1molSi原子最多可形成4molSi-O键,故C正确;
D.锌为镁型堆积,其配位数是12,属于镁型堆积的还有Ti,故D错误;
故选D.
B.分子晶体的构成微粒是分子,每个分子为一个整体,所以该分子的化学式为E4F4或F4E4,故B正确;
C.在二氧化硅晶体中,每个Si原子能构成4个Si-O键,所以1molSi原子最多可形成4molSi-O键,故C正确;
D.锌为镁型堆积,其配位数是12,属于镁型堆积的还有Ti,故D错误;
故选D.
点评:本题考查了晶体的结构,为考查热点,知道金属晶体的四种堆积模型及对应的金属,熟记以氯化钠、氯化铯、金刚石等为代表的晶体,采用知识迁移法分析解答,易错选项是B,很多同学往往用均摊法确定其化学式而导致错误,为易错点.

练习册系列答案
相关题目
下列化学反应中,属于氧化还原的化合反应是( )
| A、Na2CO3+CaCl2═CaCO3↓+2NaCl | ||||
| B、Fe+CuSO4═Cu+FeSO4 | ||||
C、2NaHCO3
| ||||
| D、Na2O2+SO2═Na2SO4 |
将镁带投入盛放在敞口容器内的盐酸里,反应速率用产生的氢气的速率表示,在下列因素中:
①盐酸的浓度,
②镁带的表面积,
③溶液的温度,
④盐酸的体积,
⑤氯离子的浓度,
其中影响反应速率的因素是( )
①盐酸的浓度,
②镁带的表面积,
③溶液的温度,
④盐酸的体积,
⑤氯离子的浓度,
其中影响反应速率的因素是( )
| A、①④ | B、③⑤ |
| C、①②③⑤ | D、①②③ |
下列化学用语说法正确的是( )
A、甲基的电子式: | ||
B、乙烯的比例模型: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、次氯酸的结构式:H─O─Cl |
地球一小时是世界自然基金会应对全球气候变化所提出的一项倡议,以此来激发人们对保护地球的责任感,同时倡导节能减排理念.下列不能达到节能减排目的是( )
| A、利用太阳能分解水获得氢气 |
| B、用家用汽车代替公交车 |
| C、利用化石燃料制造燃料电池 |
| D、在农村推广建造沼气池 |
与图中相对应的叙述是( )
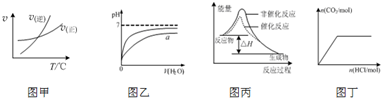

| A、由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 |
| B、图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸 |
| C、图丙表示该反应为放热反应,且催化剂能改变反应的焓变 |
| D、图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
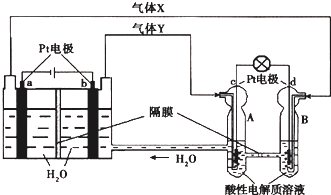

| A、当有0.1mol电子转移时,a极产生0.56L O2(标准状况下) |
| B、为了增加导电性可以将左边容器中的水改为食盐水 |
| C、c极上进行还原反应,B中的H+可以通过隔膜进入A |
| D、d极上发生的电极反应是:O2+4H++4e-═2H2O |
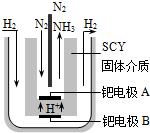 合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.