题目内容
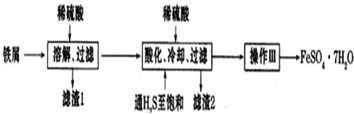
下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾( FeSO4?7H2O)的一种方法.
查资料知道数据如下表:
(1)写出生成滤渣2的离子反应方程式 .
(2)配制FeSO4溶液时应该注意的事项及原因是 .
(3)分离出滤渣2,用稀硫酸酸化的pH范围是 .
(4)称取2.850g绿矾产品配成250mL溶液,然后用滴定法则定其质量分数.如图是某同学设计的滴定方式,其中合理的是 (填序号),到达终点的现象是 .
若取25.00mL溶液置于锥形瓶中,当用0.0100mol?L-1酸性KMnO4溶液滴定时(MnO4-被还原为Mn2+),消耗的平均体积为20.00mL.样品中FeSO4?7H2O的质量分数为 [M(FeSO4?7H2O)=278].

查资料知道数据如下表:
| 25℃ | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS开始沉淀 |
| pH | 3.9 | 1.6 | 3.0 | 5.5 |
(2)配制FeSO4溶液时应该注意的事项及原因是
(3)分离出滤渣2,用稀硫酸酸化的pH范围是
(4)称取2.850g绿矾产品配成250mL溶液,然后用滴定法则定其质量分数.如图是某同学设计的滴定方式,其中合理的是

若取25.00mL溶液置于锥形瓶中,当用0.0100mol?L-1酸性KMnO4溶液滴定时(MnO4-被还原为Mn2+),消耗的平均体积为20.00mL.样品中FeSO4?7H2O的质量分数为
考点:物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量
专题:实验设计题
分析:铁屑(含少量锡、氧化铁等杂质),加入稀硫酸溶解过滤,得到滤液加入稀硫酸酸化,通H2S至饱和,防止亚铁离子被氧化,冷却过滤得到,滤渣为SnS,滤液为硫酸亚铁溶液,蒸发浓缩,冷却结晶,过滤洗涤得到硫酸亚铁晶体;
(1)滤渣2为SnS;
(2)配制FeSO4溶液时应该防止亚铁离子被氧化,亚铁离子水解变浑浊分析;
(3)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=1.6-2,为了除去杂质离子Sn2+;
(4)酸性溶液或影响溶液应在酸式滴定管中,滴定实验过程中判断终点的方法是高锰酸钾溶液的紫红色半分钟不变;依据亚铁离子被高锰酸钾溶液氧化反应的定量关系计算;
(1)滤渣2为SnS;
(2)配制FeSO4溶液时应该防止亚铁离子被氧化,亚铁离子水解变浑浊分析;
(3)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=1.6-2,为了除去杂质离子Sn2+;
(4)酸性溶液或影响溶液应在酸式滴定管中,滴定实验过程中判断终点的方法是高锰酸钾溶液的紫红色半分钟不变;依据亚铁离子被高锰酸钾溶液氧化反应的定量关系计算;
解答:
解:铁屑(含少量锡、氧化铁等杂质),加入稀硫酸溶解过滤,得到滤液加入稀硫酸酸化,通H2S至饱和,防止亚铁离子被氧化,冷却过滤得到,滤渣为SnS,滤液为硫酸亚铁溶液,蒸发浓缩,冷却结晶,过滤洗涤得到硫酸亚铁晶体;
(1)上述分析可知滤渣2为SnS,生成滤渣2的离子反应方程式为:Sn2++H2S=SnS↓+2H+;
故答案为:Sn2++H2S=SnS↓+2H+;
(2)配制FeSO4溶液时应该防止亚铁离子被氧化,亚铁离子水解变浑浊分析,加入铁粉和稀盐酸,防止亚铁离子被氧化,抑制亚铁离子水解;
故答案为:加入铁粉和稀盐酸,防止亚铁离子被氧化,抑制亚铁离子水解;
(3)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=1.6-2,为了除去杂质离子Sn2+;
故答案为:1.6-2;
(4)酸性溶液或影响溶液应在酸式滴定管中,所以应选择B装置滴定实验,到达终点的现象是滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且半分钟不褪色证明反应达到终点;依据亚铁离子被高锰酸钾溶液氧化反应的定量关系计算;
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
n (Fe2+) 0.0100mol/L×0.020L
n=0.001mol
250ml中含有FeSO4?7H2O物质的量为0.01mol,质量分数=
×100%=97.5%;
故答案为:B、滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且半分钟不褪色证明反应达到终点,97.5%;
(1)上述分析可知滤渣2为SnS,生成滤渣2的离子反应方程式为:Sn2++H2S=SnS↓+2H+;
故答案为:Sn2++H2S=SnS↓+2H+;
(2)配制FeSO4溶液时应该防止亚铁离子被氧化,亚铁离子水解变浑浊分析,加入铁粉和稀盐酸,防止亚铁离子被氧化,抑制亚铁离子水解;
故答案为:加入铁粉和稀盐酸,防止亚铁离子被氧化,抑制亚铁离子水解;
(3)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=1.6-2,为了除去杂质离子Sn2+;
故答案为:1.6-2;
(4)酸性溶液或影响溶液应在酸式滴定管中,所以应选择B装置滴定实验,到达终点的现象是滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且半分钟不褪色证明反应达到终点;依据亚铁离子被高锰酸钾溶液氧化反应的定量关系计算;
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
n (Fe2+) 0.0100mol/L×0.020L
n=0.001mol
250ml中含有FeSO4?7H2O物质的量为0.01mol,质量分数=
| 0.01mol×278g/mol |
| 2.850g |
故答案为:B、滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且半分钟不褪色证明反应达到终点,97.5%;
点评:本题考查了物质分离和提纯的分析判断,滴定实验的理解应用和计算分析,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某有机物的氧化产物是甲,还原产物是乙.甲和乙都能与钠反应放出H2,甲和乙反应生成丙,甲和丙都能发生银镜反应.该有机物是( )
| A、甲醛 | B、乙醛 | C、甲酸 | D、甲醇 |
如图中所示的实验方法、装置或操作完全正确的是( )
A、 实验室制乙烯 |
B、 分离苯酚和水 |
C、 石油的蒸馏 |
D、 实验室制乙酸乙酯 |
下列叙述中正确的是( )
| A、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| B、为了确认实验桌上标明为蔗糖和NaCl的两瓶化学药品中的实物与标签名称是否相符,可各取少量放在口里品尝一下 |
| C、“沙里淘金”利用的是金与沙的密度相差较大 |
| D、实验剩余的药品不要随意丢弃,应放回原瓶 |