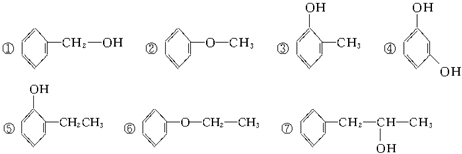
题目内容
4.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个.请回答下列问题:(1)B元素的名称为钠,E的元素符号为Cl,D的离子结构示意图为
 .
.(2)A、B、D三种元素形成的简单离子的半径由大到小的顺序是S2->O2->Na+.
(3)A、B、D、E形成的化合物B2A2、DE2、E2A、EA2中,各原子(或离子)都满足最外层8电子结构的是Na2O2、SCl2、Cl2O(填写具体物质的化学式).
(4)D、E两种元素可形成化学式为DE2、D2E2等化合物,则DE2的结构式为Cl-S-Cl,D2E2广泛用于橡胶工业,其分子结构中每个原子均满足8电子结构.D2E2的电子式为
 .常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.
.常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.A.D2E2中的D元素显+1价
B.D2E2结构中的化学键只含有极性键
C.D2Br2与D2E2结构相似,熔沸点:D2Br2>D2E2
D.D2E2与水反应的生成物中可能有单质硫
(5)用电子式表示A、B两种元素形成化合物B2A的形成过程:
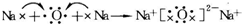 .
.(6)化合物B2A2中含有的化学键类型有bd.
a.氢键 b.离子键 c.极性键 d.非极性键
(7)DA2与E元素的单质在水中反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4.
(8)向由C、E两种元素组成的化合物溶液200mL 2mol/L中加入500mL一定浓度的KOH溶液,得到白色沉淀15.6g,则KOH溶液的物质的量浓度为1.2mol/L或2.8mol/L.
分析 短周期主族元素A、B、C、D、E的原子序数依次增大,A原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;A、D同主族,则D为S元素;E的原子序数最大,故E为Cl;B是短周期元素中原子半径最大的主族元素,则B为Na;C原子的质子数比B原子的质子数多2个,则C为Al,据此解答.
解答 解:短周期主族元素A、B、C、D、E的原子序数依次增大,A原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;A、D同主族,则D为S元素;E的原子序数最大,故E为Cl;B是短周期元素中原子半径最大的主族元素,则B为Na;C原子的质子数比B原子的质子数多2个,则C为Al.
(1)由上述分析可知,B元素的名称为:钠,E的元素符号为:Cl,D的离子为S2-,离子结构示意图为 ,故答案为:钠;Cl;
,故答案为:钠;Cl; ;
;
(2)A、B、D三种元素形成的简单离子分别为O2-、Na+、S2-,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->O2->Na+,
故答案为:S2->O2->Na+;
(3)O、Na、S、Cl形成的化合物Na2O2、SCl2、Cl2O、ClO2中,过氧化钠由钠离子与过氧根离子过程,离子均满足8电子结构,SCl2、Cl2O中各原子最外层电子数+|化合价|=8,均满足8电子结构,ClO2中Cl原子不满足8电子结构,
故答案为:Na2O2、SCl2、Cl2O;
(4)SCl2分子中S原子与Cl之间形成1对共用电子对,结构式为Cl-S-Cl,S2Cl2分子中S原子之间形成1对共用电子对,S原子与Cl原子之间形成1对共用电子对,电子式为 ;
;
A.A.S2Cl2中S与Cl原子之间的共用电子对偏向氯,故S元素显+1价,故A正确;
B.S2Cl2结构中S原子与S原子之间形成非极性键,故B错误;
C.S2Br2与S2Cl2结构相似,均形成分子晶体,S2Br2的相对分子质量较大,分子之间范德华力较强,故熔沸点:S2Br2>S2Cl2,故C正确;
D.S2Cl2遇水易水解,并产生能使品红褪色的气体,该气体为二氧化硫,根据电子转移守恒可知,S元素化合价应降低,生成物中可能有单质硫,故D正确,
故答案为:Cl-S-Cl; ;ACD;
;ACD;
(5)用电子式表示O、Na两种元素形成化合物Na2O的形成过程: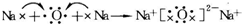 ,
,
故答案为: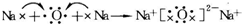 ;
;
(6)化合物Na2O2中钠离子与过氧根离子之间形成离子键,过氧根离子中氧原子之间形成非极性键,
故选:bd;
(7)SO2与氯气在水中反应生成HCl与硫酸,反应的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
(8)向由C、E两种元素组成的化合物为AlCl3,其物质的量为0.2L×2mol/L=0.4mol,如完全生成沉淀,则应生成0.4molAl(OH)3,实际得到白色沉淀15.6g,物质的量为$\frac{15.6g}{78g/mol}$=0.2mol<0.4mol,说明Al3+没有完全生成沉淀,可能存在两种情况:
①NaOH不足,铝离子部分转化氢氧化铝沉淀,则:
Al3++3OH-=Al(OH)3↓,
0.2mol 0.6mol 0.2mol
此时c(NaOH)=$\frac{0.6mol}{0.5L}$=1.2mol/L,
②NaOH部分过量,铝离子转化为氢氧化铝沉淀、偏铝酸根,则:
Al3++3 OH-=Al(OH)3↓
0.4mol 1.2mol 0.4mol
溶解的氢氧化铝为0.4mol-0.2mol=0.2mol
Al(OH)3+OH-=AlO2-+2H2O,
0.2mol 0.2mol
则c(NaOH)=$\frac{1.2mol+1.2mol}{0.5L}$=2.8mol/L,
故答案为:1.2;2.8.
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,题目综合性较强,需要学生具备扎实的基础,(8)中注意根据沉淀的质量判断发生的反应,侧重于学生的分析能力和计算能力的考查,题目难度中等.

| A. | 1.0×10-7mol•L-1 | B. | 1.0×10-6mol•L-1 | ||
| C. | 1.0×10-2mol•L-1 | D. | 1.0×10-12mol•L-1 |
| A. | 在洁净的试管中加入1-2 mL AgNO3溶液,再加入过量浓氨水,振荡,混合均匀 | |
| B. | 在洁净的试管中加入1-2 mL浓氨水,再加入AgNO3溶液至过量 | |
| C. | 在洁净的试管中加入1-2 mL稀氨水,再逐滴加入2%AgNO3溶液至过量 | |
| D. | 在洁净的试管中加入2%AgNO3溶液1-2 mL,逐滴加入2%稀氨水至沉淀恰好溶解为止 |
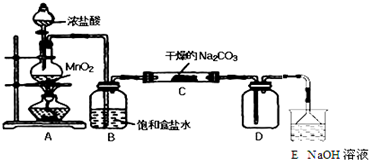
①提出合理猜想:C中一定含有NaHCO3和NaCl;可能含有剩余的Na2CO3.
②设计方案,进行成分检验.请你参与并完成实验步骤3、4以及预期现象和结论,将答案填入下表的相应空格内.限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中, 加入蒸馏水至固体溶解,然后各取1~2mL 所得溶液分别置于甲、乙两支试管中. | 得到无色溶液. |
| 步骤2:向甲试管中加入过量的BaCl2溶液, 静置. | 若溶液变浑浊,证明固体中含有Na2CO3. |
| 步骤3:取甲试管中上层清液少许于另一只 试管中,滴加少量澄清石灰水, 充分振荡. | 若上层清液变浑浊, 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中先加入过量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;证明固体中含有氯化钠. |
| A. | 原混合溶液中c(K+)为4 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
 命名该化合物时,应认定它的主链上的碳原子数目,正确的是( )
命名该化合物时,应认定它的主链上的碳原子数目,正确的是( )| A. | 8 | B. | 9 | C. | 10 | D. | 11 |
| A. | 原子半径:Z<Y<W,而离子半径:W<Y<Z | |
| B. | W的氯化物水溶液中滴加过量NaZ饱和溶液,可生成W的配合物用于冶金工业 | |
| C. | 由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 | |
| D. | 已知YX3沸点远高于YZ3,则Y-X键的键能高于Y-Z键 |
| A. |  1,3,4-三甲苯 | B. |  2-甲基-1-丙醇 | C. |  2-甲基-2-氯丙烷 | D. | 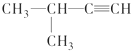 2-甲基-3-丁炔 |