题目内容
6.如图所示:A、B、C、D是初中化学中常见的不同类别的物质,已知A、B是空气中的两种气体,“?”表示两种物质在一定条件下可相互转变.依据给出的信息推断并回答下列问题:
(1)B转化为A的过程叫光合作用;
(2)B物质的一种用途是灭火(或做气体肥料或人工降雨或制碳酸饮料等);
(3)C物质所属的类别是盐;
(4)D转化为C的反应方程式是CO2+2NaOH═Na2CO3+H2O.
分析 A、B是空气中的两种气体,“?”表示两种物质在一定条件下可相互转变,判断为氧气和二氧化碳的相互转化,是呼吸作用于光合作用的反应,A、B、C、D是初中化学中常见的不同类别的物质,A为氧气,B为二氧化碳,C为碳酸钠,D是碱为氢氧化钠.
解答 解:A、B是空气中的两种气体,“?”表示两种物质在一定条件下可相互转变,判断为氧气和二氧化碳的相互转化,是呼吸作用于光合作用的反应,A、B、C、D是初中化学中常见的不同类别的物质,A为氧气,B为二氧化碳,C为碳酸钠,D是碱为氢氧化钠;
(1)B转化为A的过程是二氧化碳通过光合作用生成氧气的过程,
故答案为:光合作用;
(2)B为二氧化碳,用途利用其性质分析可知,可以利用不助然性进行灭火,也可以利用二氧化碳变化为固体,气化吸热进行人工降雨等,
故答案为:灭火(或做气体肥料或人工降雨或制碳酸饮料等);
(3)反应过程可知为:氧气变化为二氧化碳,二氧化碳和碱反应生成碳酸钠,碳酸钠和氢氧化钙反应生成氢氧化钠,则C属于盐,
故答案为:盐;
(4)D转化为C的反应是二氧化碳和氢氧化钠溶液反应生成,反应的方程式CO2+2NaOH═Na2CO3+H2O,故答案为:CO2+2NaOH═Na2CO3+H2O.
点评 本题考查了物质转化关系的分析应用,主要是碳及其化合物性质的应用,光合作用和氢氧化钠制备是解题关键,题目难度中等.

练习册系列答案
相关题目
11.下列叙述正确的是( )
| A. | 将5.85 g NaCl晶体溶入100 mL水中,制得0.1 mol/L NaCl溶液 | |
| B. | 将1体积c mol/L硫酸溶液用水稀释为5体积,得到0.2c mol/L硫酸溶液 | |
| C. | 将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L | |
| D. | 将w g a% NaCl溶液蒸发掉w/2 g水,得到4a% NaCl溶液 |
17.2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究.下列关于
${\;}_{78}^{202}$Pt的说法正确的是( )
${\;}_{78}^{202}$Pt的说法正确的是( )
| A. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质子数相同,互称为同位素 | |
| B. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的中子数相同,互称为同位素 | |
| C. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt是同一种核素 | |
| D. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质量数不同,不能互称为同位素 |
1.除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是( )
| 物质 | 杂质 | 除杂质应选用的试剂和操作方法 | |
| A | CO2 | CO | 通入O2,点燃 |
| B | NaOH固体 | Na2CO3固体 | 加入过量盐酸,蒸发 |
| C | Cu(NO3)2溶液 | AgNO3溶液 | 加入过量的铜粉,过滤 |
| D | KNO3溶液 | KOH溶液 | 加入适量的CuSO4溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
11.相同质量的下列气体中,所含原子数最多的是( )
| A. | C2H6 | B. | SO2 | C. | CO | D. | O2 |
18.某研究性学习小组设计除去锅炉水垢(CaCO3、Mg(OH)2、CaSO4)的实验,查找各物质的溶解度数据如下.
设计流程如下(所加的试剂均过量):
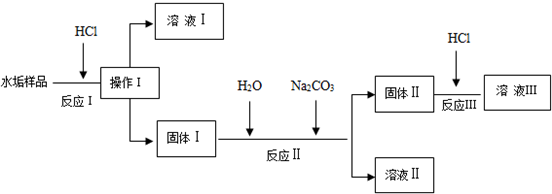
(1)操作Ⅰ的名称是过滤.
(2)溶液Ⅰ和溶液Ⅲ都含有的溶质是HCl、CaCl2.
(3)写出发生在上述过程中符合“盐+酸=另一种盐+另一种酸”特征的反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
写出反应Ⅱ的离子方程式CaSO4+CO32-=CaCO3+SO42-.
(4)上述过程中哪一步反应是利用了上述溶解度表设计的B.
A.反应ⅠB.反应ⅡC.反应Ⅲ
(5)溶液Ⅱ中的含氧酸根的检验方法是:取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子.
| 化学式 | CaSO4 | CaCO3 | Ca(OH)2 | CaCl2 |
| 溶解度/g | 0.21 微溶 | <0.01 | 0.077 | 74.5 |

(1)操作Ⅰ的名称是过滤.
(2)溶液Ⅰ和溶液Ⅲ都含有的溶质是HCl、CaCl2.
(3)写出发生在上述过程中符合“盐+酸=另一种盐+另一种酸”特征的反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
写出反应Ⅱ的离子方程式CaSO4+CO32-=CaCO3+SO42-.
(4)上述过程中哪一步反应是利用了上述溶解度表设计的B.
A.反应ⅠB.反应ⅡC.反应Ⅲ
(5)溶液Ⅱ中的含氧酸根的检验方法是:取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子.
15.下列说法错误的是( )
| A. | 1 mol 氢 | B. | 1 mol O | C. | 1 mol 二氧化碳 | D. | 1 mol水 |
16.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)?2SO3(g);△H=-a kJ•mol-1在相同条件下,要想得到 a kJ热量,加入各物质的物质的量可能的是( )
| A. | 2 molSO2和1molO2 | B. | 2molSO2和2molO2 | ||
| C. | 3molSO2和1.5molO2 | D. | 1molSO2、0.5molO2和1molSO3 |