题目内容
A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应.请回答下列问题:
(1)写出B、C、E元素的名称B 、C 、E .
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为 .
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号) ;
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为 、 ,这两种酸式盐相互反应的离子方程式为 .
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 .
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为 .
①a mol ②b mol ③
mol ④
mol ⑤0 ⑥(4a-b)mol.
(1)写出B、C、E元素的名称B
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号)
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为
①a mol ②b mol ③
| a |
| 3 |
| b |
| 3 |
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,则A为氢元素;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X,则B为氮元素,X为NH4NO3;D与A同主族,且D的原子序数大于N元素,故D为Na;F元素的最外层电子数是其次外层电子数的
倍,F原子只能有3个电子层,最外层电子数为6,故F为硫元素;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为氧元素;D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,应氢氧化铝与强碱、强酸反应,可推知E为Al,据此解答.
| 3 |
| 4 |
解答:
解:A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,则A为氢元素;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X,则B为氮元素,X为NH4NO3;D与A同主族,且D的原子序数大于N元素,故D为Na;F元素的最外层电子数是其次外层电子数的
倍,F原子只能有3个电子层,最外层电子数为6,故F为硫元素;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为氧元素;D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,应氢氧化铝与强碱、强酸反应,可推知E为Al.
(1)由上述分析可知,B、C、E元素的名称分别为:氮、氧、铝,故答案为:氮;氧;铝;
(2)O、Na两种元素形成的原子个数比为1:1的物质为Na2O2,由钠离子与过氧根离子构成,其电子式为: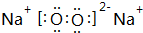 ,
,
故答案为: ;
;
(3)单质越容易与氢气反应,氢化物的还原性越强,元素的非金属性越强,单质的熔点属于物理性质,不能比较非金属性强弱,故②③正确、①错误,
故答案为:②③;
(4)H、O、N、S四种元素可以形成两种酸式盐(均由四种元素组成)分别为NaHSO3、NaHSO4,二者相互反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:NaHSO3;NaHSO4;H++HSO3-=SO2↑+H2O;
(5)H、O、S间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,则甲与乙反应的离子方程式为:HS-+OH-=S2-+H2O,
故答案为:HS-+OH-=S2-+H2O;
(6)向含有a mol AlCl3的溶液中加入含b mol NaOH的溶液,发生反应:①AlCl3+3NaOH=Al(OH)3↓+3NaCl,②AlCl3+4NaOH=NaAlO2+3NaCl,
当a:b≥1:3时,只发生反应①,二者恰好反应时得到沉淀为amol或
mol,氯化铝过量时,得到沉淀amol,小于amol,可能为
mol;
当a:b≤1:4时,只发生反应②,没有沉淀生成,即沉淀为0;
当1:3<a:b<1:4时,发生反应①②,则:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
xmol 3xmol xmol,
AlCl3+4NaOH=NaAlO2+3NaCl,
(a-x)mol 4(a-x)mol
则3xmol+4(a-x)mol=b,解得x=(4a-b),即沉淀为(4a-b)mol,由于部分铝离子转化为氢氧化铝沉淀,可能为
mol;
由氢氧根守恒可知,氢氧化铝的物质的量不可能等于NaOH物质的量,即沉淀不能为bmol,
总上分析可知,沉淀可能为①a mol、③
mol、④
mol、⑤0、⑥(4a-b)mol,不可能②b mol,
故答案为:②.
| 3 |
| 4 |
(1)由上述分析可知,B、C、E元素的名称分别为:氮、氧、铝,故答案为:氮;氧;铝;
(2)O、Na两种元素形成的原子个数比为1:1的物质为Na2O2,由钠离子与过氧根离子构成,其电子式为:
 ,
,故答案为:
 ;
;(3)单质越容易与氢气反应,氢化物的还原性越强,元素的非金属性越强,单质的熔点属于物理性质,不能比较非金属性强弱,故②③正确、①错误,
故答案为:②③;
(4)H、O、N、S四种元素可以形成两种酸式盐(均由四种元素组成)分别为NaHSO3、NaHSO4,二者相互反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:NaHSO3;NaHSO4;H++HSO3-=SO2↑+H2O;
(5)H、O、S间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,则甲与乙反应的离子方程式为:HS-+OH-=S2-+H2O,
故答案为:HS-+OH-=S2-+H2O;
(6)向含有a mol AlCl3的溶液中加入含b mol NaOH的溶液,发生反应:①AlCl3+3NaOH=Al(OH)3↓+3NaCl,②AlCl3+4NaOH=NaAlO2+3NaCl,
当a:b≥1:3时,只发生反应①,二者恰好反应时得到沉淀为amol或
| b |
| 3 |
| a |
| 3 |
当a:b≤1:4时,只发生反应②,没有沉淀生成,即沉淀为0;
当1:3<a:b<1:4时,发生反应①②,则:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
xmol 3xmol xmol,
AlCl3+4NaOH=NaAlO2+3NaCl,
(a-x)mol 4(a-x)mol
则3xmol+4(a-x)mol=b,解得x=(4a-b),即沉淀为(4a-b)mol,由于部分铝离子转化为氢氧化铝沉淀,可能为
| a |
| 3 |
由氢氧根守恒可知,氢氧化铝的物质的量不可能等于NaOH物质的量,即沉淀不能为bmol,
总上分析可知,沉淀可能为①a mol、③
| a |
| 3 |
| b |
| 3 |
故答案为:②.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握电子式书写及常见10电子、18电子微粒,(6)中计算属于字母型讨论计算,为易错点,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
金属A不纯,混有金属C,发生锈蚀时,A先腐蚀;A与金属B组成原电池时,A为电池的正极.A、B、C三种金属的活动性顺序为( )
| A、A>C>B |
| B、A>B>C |
| C、B>A>C |
| D、B>C>A |
某链状有机物M由碳、氢、氧三种元素组成,其相对分子质量为74,要使M中氢原子数最少,下列说法正确的是( )
| A、一个M的分子中有38个电子 |
| B、M中一定含有醛基和羧基 |
| C、M不存在链状的同分异构体 |
D、M的结构式为  |
 (1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: