题目内容
已知P单质在KOH溶液中变化是:8P+3KOH+9H2O=3KH2PO4+5PH3↑,下列说法正确的是( )
| A、产物PH3分子中所有的原子可能共平面 | B、该反应中P做还原剂,H2O做氧化剂 | C、相关元素的第一电离能的大小顺序:S>P>Si | D、该反应每发生0.3摩尔电子转移,PH3中就有0.3摩尔P-H键形成 |
分析:8P+3KOH+9H2O=3KH2PO4+5PH3↑中,P元素的化合价由0升高为+5价,P元素的化合价由0降低为-3价,以此来解答.
解答:解:A.产物PH3分子,为三角锥型,所有原子不能共面,故A错误;
B.P既是氧化剂又是还原剂,故B错误;
C.同周期从左向右第一电离能增大,但P原子的最外层p电子半满,为稳定结构,则元素的第一电离能的大小顺序:P>S>Si,故C错误;
D.该反应每发生0.3摩尔电子转移,生成1molPH3,则有0.3摩尔P-H键形成,故D正确;
故选D.
B.P既是氧化剂又是还原剂,故B错误;
C.同周期从左向右第一电离能增大,但P原子的最外层p电子半满,为稳定结构,则元素的第一电离能的大小顺序:P>S>Si,故C错误;
D.该反应每发生0.3摩尔电子转移,生成1molPH3,则有0.3摩尔P-H键形成,故D正确;
故选D.
点评:本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,熟悉常见物质中元素的化合价、分子构型、第一电离能比较、化学键等即可解答,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
A、B、C、D、E五种短周期元素,核电荷数依次增加,
| 元素 | 有关性质及结构信息 |
| A | A的一种原子内无中子 |
| B | B原子最外层电子数是内层电子数的2倍 |
| C | 一个C2—离子含10个电子 |
| D | A与D同族 |
| E | C与E同族 |
(1)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应。甲的一种用途是 。由甲中的两种元素组成,且与甲等电子的物质的分子式是 ,该物质与C的单质在KOH溶液中形成燃料电池的负极反应式为 。
(2)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应生成气体,该化学方程式是 。
(3)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的的分子,乙的电子式是 。已知乙的燃烧热为1200 kJ∕mol,乙燃烧热的热化学反应方程式是 。
(4)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是 。
(5)E2-基态核外电子排布式 ,C单质分子中![]() 键和
键和![]() 键的个数比是 ,C的氢化物在同族元素中沸点反常,其原因是 。
键的个数比是 ,C的氢化物在同族元素中沸点反常,其原因是 。
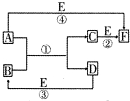 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物均未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物均未列出).