题目内容
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.v(CO)=1.5 mol·L-1·min-1 |
| B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 |
| D.v(CO2)=1.1 mol·L-1·min-1 |
C
解析试题分析:同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值。据此可知如果该反应都用CO表示反应速率,则分别是(mol·L-1·min-1)1.5、0.7×2=1.4、0.4×4=1.6、1.1,因此正确的答案选C。
考点:考查反应速率的计算和大小比较

现有三个体积相等的密闭容器中都进行如下反应:CO2+H2 CO+H2O,反应所处温度相同,但反应起始的浓度不同,其中,甲:c(H2)=c(CO2)=amol/L
CO+H2O,反应所处温度相同,但反应起始的浓度不同,其中,甲:c(H2)=c(CO2)=amol/L
乙:c(CO2)=amol/L c(H2)="2" amol/L
丙:c(CO2)=c(H2)=c(H2O)=amol/L
达到平衡时,一氧化碳的浓度由大到小排列正确的是( )
| A.丙>甲>乙 | B.甲>乙>丙 | C.乙>丙>甲 | D.乙>甲>丙 |
下列事实不能用勒夏特列原理解释的是
| A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| C.向氯水中加CaCO3后,溶液漂白性增强 |
| D.Na2CO3溶液中加酚酞,溶液变红,加热,颜色变深 |
25℃和1.01×105Pa时,反应:2N2O5(g) = 4NO2(g)+O2(g) △H= +56.76kJ/mol,自发进行的原因是
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应。 |
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2 (s)+2I2 (g)  TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)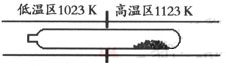
下列说法正确的是( )
| A.在不同温度区域,TaI4 的量保持不变 |
| B.在提纯过程中,I2 的量不断减少 |
| C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
| D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比 |
如图②为恒压容器,①③④为恒容容器,起始加入物如下,且起始容积均相等,维持恒温的条件下发生反应:2SO2(g)+O2(g)  2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是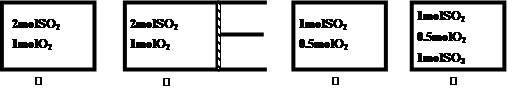
| A.197>Q1>Q2 | B.Q1>2Q3 | C.Q1=Q4 | D.Q3<Q4 |
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A. (W)=3 (W)=3 (Z) (Z) | B.2 (X)=3 (X)=3 (Z) (Z) |
C.2 (X)= (X)= (Y) (Y) | D.3 (W)=2 (W)=2 (X) (X) |
 eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数?(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数?(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )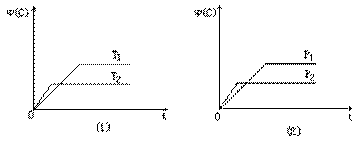
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是