题目内容
6.下列物质分离提纯的方法不正确的是( )
| A. | 用工业酒精制无水乙醇选择装置③ | B. | 提纯含砂石的粗苯甲酸选择装置①② | ||
| C. | 从溴水中提纯溴选择装置④ | D. | 苯中混有少量溴苯选择装置③ |
分析 A.可用蒸馏的方法精制无水乙醇;
B.提纯含杂质的粗苯甲酸,选择重结晶法;
C.从溴水中提纯溴,选择萃取法;
D.苯和溴苯的沸点不同.
解答 解:A.提纯含杂质的工业酒精,利用蒸馏法,则选择装置③,故A正确;
B.提纯含杂质的粗苯甲酸,因苯甲酸的溶解度随着温度的升高而升高,加热后缓慢降温会使其析出颗粒较大的晶体,所以常可以采用重结晶法的方法来提纯苯甲酸,需要加热溶解、趁热过滤、冷却结晶、滤出晶体等操作提纯苯甲酸,故B错误;
C.从溴水中提纯溴,选择萃取法,则选择装置④,故C正确;
D.苯和溴苯的沸点不同,可用蒸馏的方法分离,故D正确;
故选B.
点评 本题考查混合物分离提纯方法的选择和应用,为高频考点,把握物质的性质、性质差异及分离方法和原理为解答的关键,注意装置的作用,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
16.某氢氧燃料电池是用金属铂作电极,以KOH溶液作电解质溶液,从两极分别通入H2和O2.下列对该燃料电池的叙述中正确的是( )
| A. | 负极的电极反应式为:H2-2e-+2OH-═2H2O | |
| B. | H2应从负极通入,发生还原反应 | |
| C. | 标准状况下,通入5.6 L O2并完全反应后,有0.50 mol电子转移 | |
| D. | 放电一段时间后,通入O2的电极附近溶液的pH降低 |
1.下列说法正确的是( )
| A. | 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶 | |
| B. | 煤的主要成分是单质碳、苯、二甲苯等,可通过煤的干馏将它们分离 | |
| C. | 聚氯乙烯塑料可制作保鲜膜、一次性食品袋 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
8.研究证明:CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下:
反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的量百分数如图1所示:
请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
9. 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A. | 溶液的质量减小程度:乙<甲 | |
| B. | 溶液的导电能力变化:甲>乙 | |
| C. | 甲中阴极和乙中镁电极上析出物质质量:甲=乙 | |
| D. | 电极反应式:甲中阳极:2Cl--2e→Cl2↑,乙中正极:Cu2++2e→Cu |
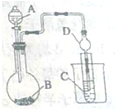 某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验. 异构化可得到三元乙丙橡胶的第三单体
异构化可得到三元乙丙橡胶的第三单体 .
.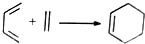 .
. .
.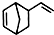 互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.
互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.