题目内容
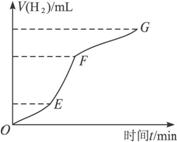
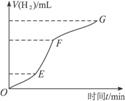
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如下图象.请回答:

(1)分析判断,________段化学反应速度最快,原因可能是____________;
FG段化学反应速率较慢的原因可能是________.
(2)为了降低该反应的反应速率,你认为可以采取哪些措施_____________(至少说出两种).
答案:
解析:
解析:
|
答案:(1)EF 反应放热,温度升高 浓度下降较快 (2)向反应体系中加水,降低酸的浓度,或加入少量CH3COONa晶体 解析:图象纵坐标为产生H2的体积,横坐标为反应的时间,所以曲线的斜率即为反应速率.增大反应速率的因素有:①增大反应物浓度,②增大反应体系压强,③升高温度,④加催化剂.但此反应过程浓度始终在下降,且为敞口体系,压强不变,也未加催化剂,所以在反应过程中浓度下降的同时速率反而提高,只能是温度的影响. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(6分)氨气跟氧化铜反应可以制备氮气,化学方程式:2NH3+3CuO 3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
| A.NH4Cl固体与消石灰(Ca(OH)2)共热 | B.浓氨水逐滴加到新制的生石灰中 |
| C.在一定条件下,N2与H2化合 | D.加热分解NH4Cl固体 |