题目内容
一定条件下硝酸铵受热分解的化学方程式(未配平)为:NH4NO3=HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为
A.5:3 B.5:4 C.1:1 D.3:5
A
【解析】
试题分析:本题中硝酸铵受热分解为氧化还原反应,遵循得失电子守恒规律,反应中—3价氮化合价升高为0价氮被氧化,+5价氮化合价降低为0价氮被还原,根据得失电子守恒规律可得被氧化的与被还原的氮原子数之比为5:3,故A正确。
考点:氧化还原反应应用得失电子守恒计算。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
.利用实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |

 的盐酸和
的盐酸和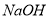 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为 、
、 、
、 、
、
 、
、 、
、 、
、
 、
、 、
、 、
、
 、
、 、
、 、
、
 H2O表示的是
H2O表示的是