题目内容
金属铜广泛地应用于电气、机械制造、国防等领域。
(1)Cu是元素周期表中第29号元素,写出第三周期基态原子未成对电子数与Cu相同且电负性最大的元素是 (填元素名称)。
(2)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
(3)下图是铜的某种氧化物的晶胞示意图。已知该晶胞的边长为a cm,阿伏加德罗常数为NA,该晶体的密度为 。

(4)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。
①SO42-中S原子的杂化方式为 。
②NH3分子内的H—N—H键角 (填“大于”“等于”或“小于”)H2O分子内的H—O—H键角。
③S、N、O三种元素第一电离能由大到小的顺序为 。
(8分)(1)氯(1分)
(2)Cu+ 的最外层电子排布为3d10,而Cu2+ 的最外层电子排布为3d9,因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO(2分)
(3) g/cm3(2分) (4)① sp3 (1分) ②大于(1分) ③ N>O>S(1分)
g/cm3(2分) (4)① sp3 (1分) ②大于(1分) ③ N>O>S(1分)
【解析】
试题分析:(1)铜元素基态原子未成对电子数是1个,则与三周期基态原子未成对电子数与Cu相同且电负性最大的元素是氟。
(2)根据构造原理可知,Cu+ 的最外层电子排布为3d10,而Cu2+ 的最外层电子排布为3d9,因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO的,所以CuO受热易分解为Cu2O和O2。
(3)根据晶胞结构特点可知,晶胞中铜原子的个数是8× +6×
+6× =4,氧原子的个数也是4个,即该氧化物是CuO。应用晶胞的边长为a cm,则
=4,氧原子的个数也是4个,即该氧化物是CuO。应用晶胞的边长为a cm,则 ×NA=4,因此晶胞的密度ρ=
×NA=4,因此晶胞的密度ρ= g/cm3=
g/cm3= g/cm3。
g/cm3。
(4)①根据价层电子对互斥理论可知,SO2—4中S原子含有的孤对电子对数=(6+2-4×2)÷2=0,即SO2—4的立体构型是正四面体,所以S原子的杂化轨道类型是sp3杂化。
②由于水分子中氧原子含有2对孤对电子,排斥力强,而氨气分子中含有1对孤对电子,所以NH3分子内的H—N—H键角大于H2O分子内的H—O—H键角。
③非金属性越强,第一电离能越大,则氧元素的第一电离能大于S元素的。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以S、N、O三种元素第一电离能由大到小的顺序为N>O>S。
考点:考查元素判断、物质稳定性、晶胞的计算、杂化轨道类型、键角比较、第一电离能比较等

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案(15分)1、下列有关元素锗及其化合物的叙述中正确的是 ___________
| A.锗的第一电离能高于碳而电负性低于碳 |
| B.四氯化锗与四氯化碳分子都是四面体构型 |
| C.二氧化锗与二氧化碳都是非极性的气体化合物 |
| D.锗和碳都存在具有原子晶体结构的单质 |
(1)铜原子基态电子排布式为 ;
(2)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g·cm-3,则阿伏加德罗常数为 (列式计算);
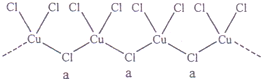
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方应程式为 。