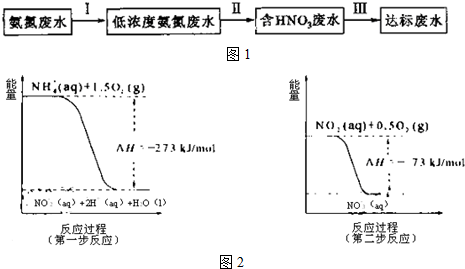
题目内容
1.将反应Mn2++Bi3-+H+→MnO4-+Bi3++H2O配平后,H+的化学计量数为( )| A. | 8 | B. | 10 | C. | 14 | D. | 30 |
分析 反应中Bi元素由+5价降低为+3价,Mn元素由+2升高为+7,结合得失电子守恒及原子个数守恒定律书写方程式,据此解答.
解答 解:反应中Bi元素由+5价降低为+3价,Mn元素由+2升高为+7,要得失电子守恒,Mn2+系数为2,Bi3-系数为5,结合原子个数守恒,反应方程式为:2Mn2++5BiO3-+14H+═2MnO4-+5Bi3++7H2O,
所以氢离子系数为17,
故选:C.
点评 本题考查氧化还原反应方程式的书写,明确氧化还原反应中得失电子守恒及原子个数守恒规律是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.在t℃时,10L 0.4mol•L-1H2O2溶液发生催化分解:2H2O2═2H2O+O2↑,不同时刻测得生成O2的体积如下表,已知反应至6min时,H2O2分解了50%(已折算为标准状况)
下列叙述正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/L | 0.0 | 9.9 | 17.2 | V=? |
| A. | 0~2min H2O2平均反应速率比4~6min慢 | |
| B. | 反应至6min时,共产生O244.8L | |
| C. | 0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol•L-1•min-1 | |
| D. | 反应至6min时,c(H2O2)=0.3mol•L-1 |
9.由于做实验时不小心使皮肤粘上了一些高锰酸钾粉末,形成的黑斑很久才能消除.如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+C2O42-+H+→CO2↑+Mn2++□. 则下列有关叙述正确的是.
| A. | 发生还原反应的是C2O42- | |
| B. | 该离子方程式右侧方框内的产物是OH- | |
| C. | 10mol H+参加反应时,电子转移5mol | |
| D. | 1mol草酸分子中含有9mol共用电子对 |
16.能说明元素X的气态原子得电子能力比元素Y的气态原子得电子能力强的事实是( )
| A. | 元素周期表中X位于Y的上一周期 | |
| B. | X的含氧酸的酸性强于Y的含氧酸的酸性 | |
| C. | 将H2X、HY分别加热至500℃,只有HY发生分解 | |
| D. | X与Y同主族,相同温度时,二者的单质与铜反应分别生成Cu2X CuY |
6.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 常温常压下,1mol固体氢氧化钠的体积比1mol氢气的体积小 | |
| B. | NA个氧气分子和NA个氢气分子的质量比为16:l | |
| C. | 28g氮气所含的原子数目为NA | |
| D. | NA个H2SO4分子中所含氧原子个数与4NA个H2O分子中所含氧原子个数相等 |
13.下列有关化学反应及其分类的叙述不正确的是( )
| A. | 金属的冶炼、电镀、燃料的燃烧、食物的腐败、钢铁的锈蚀等均属于氧化还原反应 | |
| B. | 将铁片投入硫酸铜溶液中所发生的置换反应既属于氧化还原反应,又属于离子反应 | |
| C. | 有单质参与的化学反应一定是氧化还原反应 | |
| D. | 氧化还原反应一定发生电子转移 |
 短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题:
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题: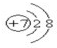 ,元素D位于元素周期表的第ⅥA族.
,元素D位于元素周期表的第ⅥA族. +2
+2 →
→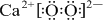 .
.