题目内容
10.amL三种气态烃的混合物与足量氧气混合点燃爆炸后,恢复到原来的状态(常温常压),体积共缩小2amL.则三种烃可能是( )| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | ||
| C. | CH4 C2H6 C3H8 | D. | C2H4 C2H2 CH4 |
分析 设烃的混合物的平均化学式为CxHy,在氧气中燃烧的化学方程式为CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),根据体积变化,利用差量法计算.
解答 解析:设混合烃的平均组成为CxHy,根据完全燃烧通式
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l)△V
1 1+$\frac{y}{4}$
a 2a
则1+$\frac{y}{4}$=2 解得y=4
即混合气体分子中平均含有4个H原子.
故选:A.
点评 本题考查混合物的计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度中等,注意利用差量法计算.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
6.下列各对物质中属于同分异构体的是( )
| A. | ${\;}_6^{12}$C与${\;}_6^{13}$C | B. | O2与O3 | ||
| C. |  与 与 | D. | 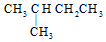 与 与 |
4.用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:
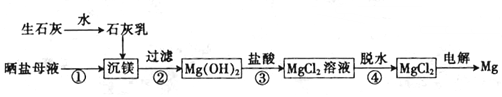
下列说法错误的是( )

下列说法错误的是( )
| A. | 上述工艺流程中未涉及置换反应 | |
| B. | 设计步骤①、②、③的主要目的是富集MgCl2 | |
| C. | 脱水时在HCl气氛中进行可防止MgCl2发生水解 | |
| D. | 电解得到的炽热镁粉可在二氧化碳气氛中冷却 |
5.某工厂对工业污泥中的Cr元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见表:
(1)实验室用98%(密度为1.84g•cm-3)的浓硫酸配制200mL 4.8mol•L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为52.2 mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需200mL容量瓶,胶头滴管.
(2)过滤操作时,需要对沉淀进行洗涤,洗漆沉淀的方法是沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次.
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离:另一方面是2Fe2++H2O2+2H+=2Fe3++2H2O.(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是Al3+、Fe3+.
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
Na2Cr2O7+3SO2+11H2O=2Cr(OH)(H2O)5SO4+1Na2SO4.

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(2)过滤操作时,需要对沉淀进行洗涤,洗漆沉淀的方法是沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次.
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离:另一方面是2Fe2++H2O2+2H+=2Fe3++2H2O.(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是Al3+、Fe3+.
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
Na2Cr2O7+3SO2+11H2O=2Cr(OH)(H2O)5SO4+1Na2SO4.
15.海洋中有丰富的资源,按图所示工艺流程可利用海水获得Br2:下列描述不正确的是( )

| A. | 从海水中提取溴,一般要经历浓缩、氧化、还原富集和再氧化等步骤 | |
| B. | 利用溴的挥发性,鼓入热空气或水蒸气,就可将溴吹出来 | |
| C. | 第②步发生反应的离子方程式为:SO2+Br2+2H2O═4H++2Br-+SO42- | |
| D. | 要除去产品溴中的少量氯气,可依次加入NaOH溶液及苯 |
2.有关氧化还原反应的叙述正确的是( )
| A. | 有单质参加或有单质生成的化学反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应属于氧化还原反应 | |
| C. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| D. | 氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
19.锂电池是一代新型高能电池,它以质量轻、能量高而受到普遍重视,目前已成功研制多种锂电池.某种锂电池的总反应为Li+MnO2═LiMnO2,下列说法正确的是( )
| A. | Li是正极,电极反应为Li-e-═Li+ | |
| B. | Li是负极,电极反应为Li-2e-═Li2+ | |
| C. | MnO2是负极,电极反应为MnO2+e-═MnO2- | |
| D. | Li是负极,电极反应为Li-e-═Li+ |
20.二氯化二硫(S2Cl2)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H2O相似,熔点为193K,沸点为411K,遇水很容易反应,产生的气体能使品红褪色,S2Cl2可由干燥的氯气通入熔融的硫中制得.下列有关说法正确的是( )
| A. | S2Cl2晶体中存在离子键和极性共价键 | |
| B. | S2Cl2分子中各原子均达到8电子稳定结构 | |
| C. | S2Cl2的水溶液能导电,所以S2Cl2是电解质 | |
| D. | S2Cl2与水反应后生成的气体通入石蕊试液中,现象是溶液先变红后褪色 |
 已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( )
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( )