题目内容
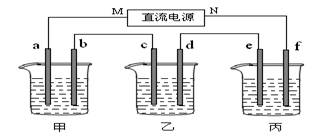
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液.电极均为石墨电极.
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为________;
③列式计算电极b上生成的气体在标准状况下的体积:________;
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液________;
乙溶液________;
丙溶液________;
(2)如果电解过程中铜全部析出.此时电解能否继续进行,为什么?__________.
答案:
解析:
解析:
|
(1)①正 ②4OH--4e-=2H2O+O2↑ ③水减少的质量:100 g×(1- 生成O2体积: ④16 ⑤碱性增大,因为电解后,水量减少溶液是NaOH浓度增大 酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加 酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性 (2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应. |

练习册系列答案
相关题目
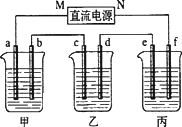
(12分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42—、OH- |


接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)写出乙烧杯的电解池反应
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。