题目内容
0.030mol铜完全溶于HNO3,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol.该混合气体平均相对分子质量可能是( )A.30 B.46 C.50 D.66
答案:BC
解析:
解析:
| 解析:考查氧化还原反应及氮的氧化物有关计算.该题可用讨论法及极值法来求解.
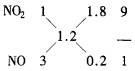
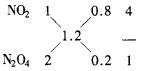
解法一:讨论法 先求出混合气体平均下降的化合价数x,0.05x=0.03×2 x=1.2,而NO为3,NO2为1,N2O4为2,所以混合气体有三种可能:NO2与NO,NO2与N2O4,NO、NO2与N2O4.假设只有NO2与NO
假设为NO2与N2O4,则
解法二:极值法. 假设混合气体为NO与NO2,设分别为xmol和ymol则:
假设混合气体为NO2与N2O4设分别为xmol和ymol则:
混合气体为NO与N2O4不可能 故:混合气体平均相对分子质量在44.4与55.2之间.
|

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目