题目内容
N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如 下,用
下,用 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是


A.使用催化剂,合成氨反应放出的热量减少
B.在该过程中,N2、H2断键形成N原子和H原子
C.在该过程中,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示。
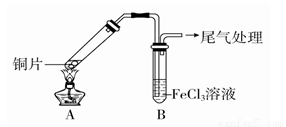
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1, |
FeCl3溶液显酸性的原因是_______________________(用离子方程式表示)。写出装置A中产生SO2的化学方程式:______________________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应。将混合液放置12小时,溶液才变成浅绿色。
【资料】[Fe(HSO3)]2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成[Fe(HSO3)]2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_____________________。
写出溶液中[Fe(HSO3)]2+离子与Fe3+反应的离子方程式:_________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②③的实验。
步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO |
用铁氰化钾K3[Fe(CN)6] 溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为______________
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.___________________ ___ _______。
___ _______。
实验室用右图装置完成下表所列的四个实验,不能达到实验目的是

选项 | 实验目的 | 试剂X | 试剂Y |
A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
B | 检验FeSO4受热分解产生的气体中有SO3和SO2 | Ba | 品红溶液 |
C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |


 取少量装入试管B中,加热A
取少量装入试管B中,加热A H2O(未配平)。则有关叙述不正确的是
H2O(未配平)。则有关叙述不正确的是 Cl2溶液
Cl2溶液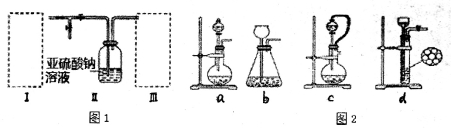
 盐水 b、NaOH溶液 c、浓硫酸 d、饱和NaHCO3溶液
盐水 b、NaOH溶液 c、浓硫酸 d、饱和NaHCO3溶液 的硬度和耐磨性,可用于制造汽车发动机
的硬度和耐磨性,可用于制造汽车发动机