��Ŀ����
����Ŀ����ش��ȼҵ���������⣺
��1���������ռ��ǵ��ʳ��ˮʱ���չ̶��ı���k�������ȣ����ɵIJ�Ʒ��������k=
��2��ԭ�ϴ����г�������ɳ��Ca2+��Mg2+��Fe3+��SO42�������ʣ����뾫�ƺ���ܹ����ʹ�ã�����ʱ����������ˮ���˺�Ҫ������Լ��ֱ�Ϊ��Na2CO3�������� ��BaCl2 �� �������Լ����ӵĺ���˳����������ţ�
��3���ȼҵ�Ǹߺ��ܲ�ҵ��һ�ֽ�������ȼ�ϵ������ϵ��¹��տ��Խ���30%���ϣ������ֹ�������У�������ϵĴ�����ת����ϵ��ͼ��ʾ�����еĵ缫δ��������õ�����Ĥ��ֻ����������ͨ���� 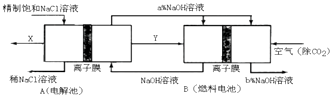
��ͼ��X��Y�ֱ��������ѧʽ���������Ƚ�ͼʾ������������������a%��b%�Ĵ�С ��
�ڷֱ�д��ȼ�ϵ��B�������������Ϸ����ĵ缫��Ӧ���� ��
���𰸡�
��1��![]() =
= ![]() =1��1.13��0.89
=1��1.13��0.89
��2���ۢ٢�
��3��Cl2��H2��a%��b%��O2+4e��+2H2O=4OH����H2��2e��+2OH��=2H2O
���������⣺��1����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ2NaCl+2H2O ![]() 2NaOH+H2��+Cl2������������k=
2NaOH+H2��+Cl2������������k= ![]() =
= ![]() =1��1.13��0.89�����Դ��ǣ�
=1��1.13��0.89�����Դ��ǣ� ![]() =
= ![]() =1��1.13��0.89����2��Ӧ�ȼ������BaCl2 �� ��ȥSO42�� �� Ȼ��ӹ���Na2CO3 �� �ɳ�ȥCa2+��Mg2+��Fe3+�ȣ����˺��������ɳ�ȥNa2CO3 �� ���Դ��ǣ��ۢ٢ڣ���3����ͨ����һ��Ϊ��������ԭ��Ӧ������ô��߱�ȻͨH2 �� ����Y��ΪH2 �� ��������ӦΪ����������Cl2 �� ����ȼ�ϵ����������O2+4e��+2H2O=4OH�� �� ȼ�ϵ���е�����Ĥֻ����������ͨ������ȼ�ϵ�������������õ����Ӳ���OH�� �� ���Է�Ӧ���������Ƶ�Ũ�����ߣ���a%С��b%����֪NaOHŨ������
=1��1.13��0.89����2��Ӧ�ȼ������BaCl2 �� ��ȥSO42�� �� Ȼ��ӹ���Na2CO3 �� �ɳ�ȥCa2+��Mg2+��Fe3+�ȣ����˺��������ɳ�ȥNa2CO3 �� ���Դ��ǣ��ۢ٢ڣ���3����ͨ����һ��Ϊ��������ԭ��Ӧ������ô��߱�ȻͨH2 �� ����Y��ΪH2 �� ��������ӦΪ����������Cl2 �� ����ȼ�ϵ����������O2+4e��+2H2O=4OH�� �� ȼ�ϵ���е�����Ĥֻ����������ͨ������ȼ�ϵ�������������õ����Ӳ���OH�� �� ���Է�Ӧ���������Ƶ�Ũ�����ߣ���a%С��b%����֪NaOHŨ������
���Դ��ǣ�Cl2��H2��a%С��b%�� ��ȼ�ϵ�������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪO2+4e��+2H2O=4OH�� �� ��������ʧ���ӷ���������Ӧ���缫��ӦʽΪH2��2e��+2OH��=2H2O��
���Դ��ǣ�O2+4e��+2H2O=4OH����H2��2e��+2OH��=2H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���������������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ����Ӧ�õ��������߿Ƽ�����
��1����֪�����ڽ���Ԫ��A��B���䵥�ʵ�λ������ȼ���ȴ�����ȼ�ϣ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�����ܣ�kJ/mol�� | I1 | I2 | I3 | I4 |
A | 899.5 | 1757.1 | 14848.7 | 21006.6 |
B | 738 | 1451 | 7733 | 10540 |
�ٸ����������ݷ�����B�����ڱ���λ�����������ӦΪ��
����ijͬѧ��Bԭ�ӵĻ�̬��Χ�����Ų�ʽд����ns1np1 �� Υ����ԭ����
��BԪ�صĵ�һ�����ܴ���Al��ԭ������
��2��������Ϊһ�������Դ�����������Ĵ������⣬C60������������ϣ�����֪���ʯ�е�C��C�ļ���Ϊ154.45pm��C60��C��C����Ϊ145��140pm����ͬѧ�ݴ���ΪC60���۵���ڽ��ʯ������Ϊ�Ƿ���ȷ���������� ��
��C60������ÿ��̼ԭ��ֻ�����ڵ�3��̼ԭ���γɹ��ۼ�����ÿ��̼ԭ������㶼����8��������ȶ��ṹ����C60�����ЦҼ���м�����Ŀ֮��Ϊ ��
