题目内容
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2OA.Cu2S既是氧化产物又是还原产物?
B.5 mol FeS2发生反应,有10 mol电子转移?
C.产物中的![]() 有一部分是氧化产物?
有一部分是氧化产物?
D.FeS2只作还原剂
思路解析:分析元素价态变化,?
得![]() Cu得电子,被还原?
Cu得电子,被还原?
![]() S得电子,被还原?
S得电子,被还原?
![]() S失电子,被氧化?
S失电子,被氧化?
Cu2S仅是还原产物,A不正确。?
5 mol FeS2和14 mol CuSO4正好反应,反应过程中Cu得电子:14×1 mol=14 mol,S得电子:7×1 mol=7 mol,S失电子:3×7 mol=21 mol,反应中电子转移了21 mol,B不正确。?
FeSO4中部分![]() 是由FeS2中S元素失电子形成的,是氧化产物,C正确。?
是由FeS2中S元素失电子形成的,是氧化产物,C正确。?
FeS2既用作氧化剂又用作还原剂。?
答案:C?

练习册系列答案
相关题目
从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
则关于该反应的说法正确的是( )
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
则关于该反应的说法正确的是( )
| A、Cu2S既是氧化产物又是还原产物 | ||
| B、5mol FeS2发生反应,有10mol电子转移 | ||
| C、FeS2只作还原剂 | ||
D、产物中的SO
|
 。下列说法正确的是
。下列说法正确的是 既是氧化产物又是还原产物
既是氧化产物又是还原产物 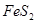 发生反应,有10 mol电子转移
发生反应,有10 mol电子转移 有一部分是氧化产物
有一部分是氧化产物