题目内容
8.下列对于混合气体的描述,正确的是(NA为阿伏伽德罗常数)| A. | 分子数为NA的CO和N2的混合气体体积为22.4L,平均相对分子质量为28 | |
| B. | 体积不变的容器中进行的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,随着反应的进行气体密度逐渐减小 | |
| C. | Na2O2和NH4Cl浓溶液反应得到混合气体的平均相对分子质量可能是34 | |
| D. | 对于反应I2(g)+H2(g)$\stackrel{△}{?}$2HI(g)而言,达到平衡后,气体的平均相对分子质量不变 |
分析 A.摩尔质量在数值上等于其相对分子质量,根据M=$\frac{m}{n}$分析,根据温度和压强影响气体的体积及混合气体体积为22.4L未知是否为标准状况下判断;
B.根据ρ=$\frac{m}{V}$,反应前后都是气体,气体质量不变,恒容容器,V不变;
C.Na2O2和 NH4Cl浓溶液中的水反应生成氧气和氢氧化钠,氢氧化钠和浓氯化铵溶液反应生成氨气和氯化钠;
D.根据M=$\frac{m}{n}$分析,摩尔质量在数值上等于其相对分子质量,该反应混合气体的摩尔质量始终不变.
解答 解:A.分子数为NA的CO、N2混合气体的物质的量为1mol,摩尔质量在数值上等于其相对分子质量,CO、N2摩尔质量都为28g/mol,根据M=$\frac{m}{n}$1molCO、N2混合气体的平均相对分子质量为28,但CO、C2H4混合气体所处的状态不明确,体积不一定是22.4L/mol,无法计算混合气体的体积,故A错误;
B.根据ρ=$\frac{m}{V}$,反应前后都是气体,气体质量不变,恒容容器,V不变,所以容器内气体密度始终不变,故B错误;
C.Na2O2和 NH4Cl浓溶液中的水反应:2Na2O2+2H2O═4NaOH+O2↑,氢氧化钠和浓氯化铵溶液反应NH4Cl+NaOH=NaCl+NH3↑+H2O,摩尔质量在数值上等于其相对分子质量,O2、NH3摩尔质量分别为32g/mol、17g/mol,所以得到混合气体的平均相对分子质量应介于17g/mol-32g/mol之间,故C错误;
D.反应前后气体的物质的量不变,质量守恒,所以混合气体的摩尔质量始终不变,所以达到平衡后,气体的平均相对分子质量不变,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,侧重考查摩尔质量与相对分子量的有关计算,注意M=$\frac{m}{n}$、ρ=$\frac{m}{V}$公式的运用,22.4L/mol的使用条件,注意C选项的极限法,题目难度中等.


| A. | 丙中可能含有未反应的甲,可用溴水检验是否含甲 | |
| B. | 反应(1)的无机试剂是液溴,铁作催化剂 | |
| C. | 甲和丙均可与酸性KMnO4溶液发生反应 | |
| D. | 反应(2)反应属于取代反应 |
| A. | 三种元素可组成CAB2和CAB3型化合物 | |
| B. | 离子半径:A3->B2->C+ | |
| C. | 氢化物稳定性:AH3>H2B | |
| D. | B的某种单质可用于杀菌消毒 |
| A. | 铝热反应原理是炼铁最常用的反应原理 | |
| B. | 氧化铝熔点很高,可用作耐火材料 | |
| C. | 过氧化钠可以用作呼吸面具中的供氧剂 | |
| D. | 青铜是我国使用最早的合金 |
| 选项 | 甲 | 乙 | 丙 | 实验结论 | 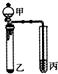 |
| A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:碳>硅 | |
| B | 双氧水 | MnO2 | Na2S | 氧化性:H2O2>O2>S | |
| C | 浓硫酸 | Na2SO3 | 酸性KMnO4溶液 | SO2具有漂白性 | |
| D | 浓氨水 | 氢氧化钠固体 | 酚酞 | 碱性:NaOH>NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
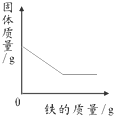
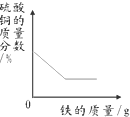
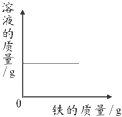

 2014年3.15晚会的主题为“让消费更有尊严”,食品行业依旧是消费者最为关注的行业.频发的食品安全事件,让公众几乎患上了“食物焦虑症”.国际环保组织绿色和平发布报告,称对“立顿”的绿茶、茉莉花茶和铁观音袋泡茶检验,发现含有被国家禁止在茶叶上使用的高毒农药灭多威.灭多威是一种白色晶状固体,略具有硫磺的气味,其化学式为C5H10N2O2S.
2014年3.15晚会的主题为“让消费更有尊严”,食品行业依旧是消费者最为关注的行业.频发的食品安全事件,让公众几乎患上了“食物焦虑症”.国际环保组织绿色和平发布报告,称对“立顿”的绿茶、茉莉花茶和铁观音袋泡茶检验,发现含有被国家禁止在茶叶上使用的高毒农药灭多威.灭多威是一种白色晶状固体,略具有硫磺的气味,其化学式为C5H10N2O2S. 自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.