题目内容
下列离子方程式书写正确的是( )
A、NaHSO4溶液与Ba(OH)2溶液反应至中性H++SO
| ||
| B、NaClO溶液与FeCl2溶液混合Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | ||
C、NH4HSO3溶液与足量NaOH溶液反应NH
| ||
D、0.2 mol?L-1的NH4Al(SO4)2溶液与0.3 mol?L-1的Ba(OH)2溶液等体积混合 2Al3++3SO
|
考点:离子方程式的书写
专题:离子反应专题
分析:A、溶液呈中性,说明氢离子和氢氧根离子的物质量相等,设都为1mol,1molOH-同时电离出0.5moBa2+而产生lmolH+同时产生1molSO42-,硫酸根离子过量;
B、两者发生氧化还原反应;
C、亚硫酸氢根离子也参加了反应,而且两者的量之比为1:1;
D、设体积为10L,则2mol的NH4Al(SO4)2溶液电离出铵根离子和铝离子,首先作用的是铝离子,而2mol的铝离子刚好需6mol的氢氧根离子.
B、两者发生氧化还原反应;
C、亚硫酸氢根离子也参加了反应,而且两者的量之比为1:1;
D、设体积为10L,则2mol的NH4Al(SO4)2溶液电离出铵根离子和铝离子,首先作用的是铝离子,而2mol的铝离子刚好需6mol的氢氧根离子.
解答:
解:A、溶液呈中性,说明氢离子和氢氧根离子的物质量相等,设都为1mol,1molOH-同时电离出0.5moBa2+而产生lmolH+同时产生1molSO42-,硫酸根离子过量,正确的离子方程式为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故A错误;
B、两者发生氧化还原反应,当NaClO少量时的离子方程式为6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-,故B错误;
C、亚硫酸氢根离子也参加了反应,而且两者的量之比为1:1,离子方程式为NH4++HSO3-+2OH-═NH3?H2O+H2O+SO32-,故C错误;
D、设体积为10L,则2mol的NH4Al(SO4)2溶液电离出铵根离子和铝离子,首先作用的是铝离子,而2mol的铝离子刚好需6mol的氢氧根离子,正确的离子方程式为 2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故D正确;
故选D.
B、两者发生氧化还原反应,当NaClO少量时的离子方程式为6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-,故B错误;
C、亚硫酸氢根离子也参加了反应,而且两者的量之比为1:1,离子方程式为NH4++HSO3-+2OH-═NH3?H2O+H2O+SO32-,故C错误;
D、设体积为10L,则2mol的NH4Al(SO4)2溶液电离出铵根离子和铝离子,首先作用的是铝离子,而2mol的铝离子刚好需6mol的氢氧根离子,正确的离子方程式为 2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故D正确;
故选D.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
| B、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、SO42- |
| C、能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- |
| D、c(Al3+)=0.5mol?L-1的溶液中:Na+、K+、[Al(OH)4]-、SO42- |
下列说法不正确的是( )
| A、化学反应的速率越大,化学反应的限度越大 |
| B、化学反应中既有物质变化,又有能量变化 |
| C、化学反应的实质是旧键的断裂,新键的形成 |
| D、可逆反应达到化学平衡状态,反应依然在进行 |
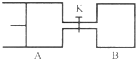 如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D、打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |
甲、乙两个烧杯中分别加入含等物质的量的硫酸溶液,向甲中加入mgMg,向乙中加入mgZn,反应结束后,一烧杯中仍有金属未溶解,则甲、乙两个烧杯中含硫酸的物质的量(n)的值是( )
A、
| ||||
B、n=
| ||||
C、m/65<n=
| ||||
D、
|

 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g,试回答:
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g,试回答: 金属镍及其化合物在能源、材料等工业中都有重要用途.
金属镍及其化合物在能源、材料等工业中都有重要用途.