题目内容
在Al、Au、Cu、Fe、Na五种金属中,具有下述性质的分别是:常温下与水激烈反应的是________,不溶于冷浓硝酸,但溶于稀盐酸或苛性钠溶液的是________,不溶于冷浓硝酸,也不溶于苛性钠溶液的是________,不溶于稀硫酸或盐酸中,但能溶于硝酸或热的浓硫酸中的是________,不溶于盐酸、硫酸、硝酸及苛性钠溶液,但溶于“王水”的是________。
答案:Na, Al, Fe, Cu,Au

练习册系列答案
相关题目
某探究小组废弃的印刷线路板(含Cu、Al少量Au、Pt等金属的混合物回收Cu并制备硫酸铝晶体[Al2(SO4)3.18H2O],设计路线如下:
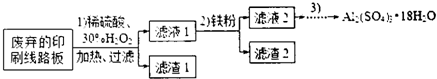
(1)过滤时所需要的玻璃仪器有玻璃棒、 、 .
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是 .
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:2Cu2++4I-=2CuI(白色)↓+I2,2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用 .
②滴定终点观察到的现象为 .
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会 (填“偏高”、“偏低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
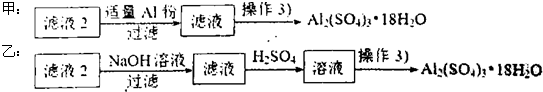
①操作③的实验步骤依次为:蒸发浓缩: 、 、洗涤.
②从原子利用率角度考虑, 方案更合理.(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
①氧化需加入H2O2而不用Cl2的原因是 .
②调节溶液pH约为 .

(1)过滤时所需要的玻璃仪器有玻璃棒、
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:2Cu2++4I-=2CuI(白色)↓+I2,2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用
②滴定终点观察到的现象为
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:

①操作③的实验步骤依次为:蒸发浓缩:
②从原子利用率角度考虑,
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.8 | 5.2 |
②调节溶液pH约为
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: