题目内容
11.甲醇是重要的化工原料,在工业生产上的应用十分广泛,二氧化碳被认为是加剧温室效应的主要来源,如何有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.(1)将CO2转化成甲醇燃料是减排、环保的一种科学方法.
已知:2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ•mol-1 ①
2CO2(g)+4H2O(g)
2CH3OH(g)+3O2(g);△H=+1352.8kJ•mol-1②
则反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的△H=-49kJ•mol-1
(2)500℃时,在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,回答下列问题:

①计算从反应开始到10min时,H2的反应速率及该温度下反应的平衡常数.
(写出具体的计算过程)
②下列措施不能使CO2的转化率增大的是AD.(双选)
A.在原容器中再充入lmol CO2
B.在原容器中再充入1mol H2
C.将反应体系温度降低
D.使用更有效的催化剂
③升高温度,800℃时,在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2,在上图中画出CH3OH 浓度随时间变化的曲线(不需要定量计算).
分析 (1)2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ•mol-1 ①
2CO2(g)+4H2O(g)=2CH3OH(g)+3O2(g);△H=+1352.8kJ•mol-1②
则根据盖斯定律(①×3+②)×$\frac{1}{2}$计算;
(2)①根据v=$\frac{△c}{△t}$计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);依据图象和平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
②A.在原容器中再充入lmolCO2,平衡向正反应方向移动,但CO2的转化率减小;
B.在原容器中再充入1molH2,平衡向正反应方向移动,CO2的转化率增大;
C.温度降低,平衡向放热反应方向移动;
D.催化剂只改变反应速率,不改变平衡移动;
③因为该反应为放热反应,所以升高温度,平衡向逆反应方向移动,则在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2时,生成的CH3OH 浓度小于0.75mol/L.
解答 解:(1)2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ•mol-1 ①
2CO2(g)+4H2O(g)=2CH3OH(g)+3O2(g);△H=+1352.8kJ•mol-1②
则根据盖斯定律(①×3+②)×$\frac{1}{2}$则CO2(g)+3H2(g)=CH3OH(g)+H2O(g);△H=(-483.6×3+1352.8)×$\frac{1}{2}$=-49 kJ•mol-1;故答案为:-49 kJ•mol-1;
(2)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,故v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=0.075mol/(L.min)×3=0.225mol/(L.min),
CO2(g)+3H2(g)$\stackrel{一定条件}{?}$CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
K=$\frac{0.75×0.75}{0.25×0.75{\;}^{3}}$=5.3
答:H2的反应速率为0.225mol/(L.min);平衡常数为5.3;
②A.在原容器中再充入lmolCO2,平衡向正反应方向移动,但CO2的转化率减小,故A选;
B.在原容器中再充入1molH2,平衡向正反应方向移动,CO2的转化率增大,故B不选;
C.温度降低,平衡向放热反应方向移动,该反应为放热反应,所以向正反应方向移动,则CO2的转化率增大,故C不选;
D.催化剂只改变反应速率,不改变平衡移动,所以CO2的转化率不变,故D选;
故答案为:AD;
③因为该反应为放热反应,所以升高温度,平衡向逆反应方向移动,则在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2时,生成的CH3OH 浓度小于0.75mol/L,则CH3OH 浓度随时间变化的曲线 ,故答案为:
,故答案为: .
.
点评 本题为综合题,涉及化学平衡影响因素分析、平衡常数计算、反应热的计算、热化学反应方程式的书写等知识点,注重高考常考考点的考查,题目难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 能使溴水褪色 | ||
| C. | 在一定条件下可以发生加聚反应 | D. | 一定条件下,能和NaOH醇溶液反应 |
| A. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| B. | NH5中既有共价键又有离子键,是离子化合物 | |
| C. | NH5的熔沸点高于NH3 | |
| D. | NH5固体投入少量水中,可产生两种气体 |
| A. | CH3-CH2-CH2-CH3 | B. | CH3-CH═CH-CH2-CH3 | ||
| C. |  | D. | CH3-C≡C-CH3 |
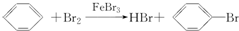
将甲苯与液溴混合,加入铁粉,其反应产物可能有( )
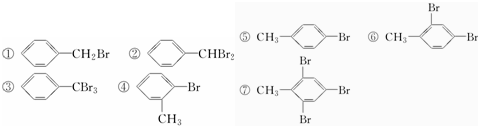
| A. | 只有①②③ | B. | 只有④⑤⑥⑦ | C. | 只有①⑤ | D. | ①②③④⑤⑥⑦ |
| A. | ②③④ | B. | ①②③ | C. | ①②④ | D. | ①③④ |
| A. | 6:1 | B. | 12:1 | C. | 1:1 | D. | 1:2 |
| A. | 氮原子的价电子排布图: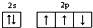 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第VA族,是p区元素 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 第一电离能和电负性:1s22s22p4>1s22s22p3 |
| A. | 汽油 | B. | 煤 | C. | 乙烯 | D. | 石油裂解气 |