题目内容
如下图所示,甲、乙两试管中各放一枚铁钉,甲试管中为NH4Cl溶液,乙试管为NaCl溶液。数天后观察到的现象是______________,甲中正极反应为______________,乙中正极反应为______________。试管中残留气体平均相对分子质量的变化为:甲______________,乙______________。
解析:该题在析氢腐蚀与吸氧腐蚀的基础上,综合气压原理、平均相对分子质量概念,增强了题目的综合性。NH4Cl溶液水解显酸性,甲试管中发生析氢腐蚀,生成氢气,气压增高,NaCl溶液呈中性,乙试管中发生吸氧腐蚀,氧气被消耗,气压降低,所以左侧导管中水柱下降,右侧导管中水柱上升。又由于甲试管中生成了摩尔质量小的氢气,乙试管中消耗了摩尔质量大的氧气,甲、乙两试管中残留气体平均相对分子质量都会减小。
答案:左侧导管中水柱下降,右侧导管中水柱上升 2H++2e-![]() H2↑
H2↑
2H2O+O2+4e-![]() 4OH- 变小 变小
4OH- 变小 变小

练习册系列答案
相关题目
(15分)、如下图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题: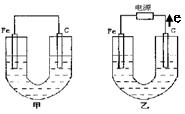
(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH—)约为 ,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的 
| A.盐酸 | B.NaCl固体 | C.NaCl溶液 | D.HCl气体 |
①反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②写出乙池通电时总反应的离子方程式: 。
③若乙池中通过1.2mol 电子后停止实验,则乙池中共可收集到气体的体积为(标准状况下)


