题目内容
【题目】常温下,下列各组比值为1∶2的是( )
A.0.1mol·L-1与0.2mol·L-1 CH3COOH溶液,c(H+)之比
B.0.1mol·L-1 Na2CO3溶液,![]()
![]() c(Na+)之比
c(Na+)之比
C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D.pH=3的H2SO4与CH3COOH溶液,![]()
![]() c(CH3COO-)之比
c(CH3COO-)之比
【答案】D
【解析】
A.醋酸是弱电解质,溶液中存在电离平衡,醋酸浓度越大其电离程度越小,所以0.1mol/L与0.2mol/L醋酸溶液,c(H+)之比大于1:2,故A错误;
B.0.1molL1Na2CO3溶液,CO32-离子水解浓度减小,![]() 与c(Na+)之比小于1:2,故B错误;
与c(Na+)之比小于1:2,故B错误;
C.Ba(OH)2为强电解质,完全电离,氨水为弱电解质溶液,部分电离,所以pH=10的Ba(OH)2溶液与氨水,c[Ba(OH)2]=![]() ×c(OH)=0.00005mol/L,c(氨水)>0.0001mol/L,溶质的物质的量浓度之比小于1:2,故C错误;
×c(OH)=0.00005mol/L,c(氨水)>0.0001mol/L,溶质的物质的量浓度之比小于1:2,故C错误;
D.pH=3的硫酸与醋酸溶液中氢离子浓度相等,根据电荷守恒得c(H+)=2c(SO42)=c(CH3COO),所以c(SO42)与c(CH3COO)之比等于1:2,故D正确;
故选D。

【题目】(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____。又已知:H2O(g)=H2O(l);△H2=﹣44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是___kJ。
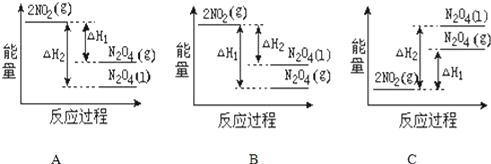
(2)已知:2NO2(g)═N2O4(g) △H1 2NO2(g)═N2O4(l) △H2,下列能量变化示意图中,正确的是(选填字母)______。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2 599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:__。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。已知某些化学键的键能数据如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能/kJmol﹣1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为_______。