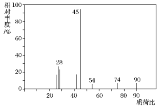
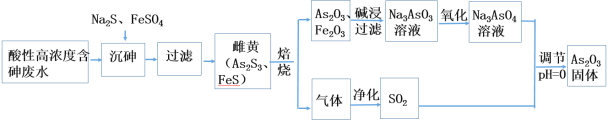
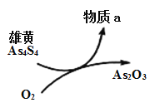
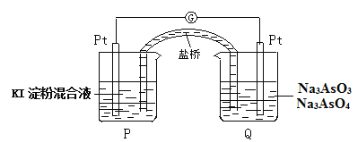
题目内容
【题目】已知:2H2(g) +O2(g)=2H2O(g) ΔH =-483.6 kJmol1
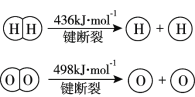
下列说法不正确的是
A.该反应可作为氢氧燃料电池的反应原理
B.破坏1 mol H-O键需要的能量是463.4 kJ
C.H2的燃烧热ΔH<-241.8 kJ·mol1
D.H2(g)中的H-H键比H2O(g)中的H-O键牢固
【答案】D
【解析】
反应热等于所有反应物的键能总和减去所有生成物的的键能总和。
A.放热的氧化还原反应可设计成原电池,因此该反应可作为氢氧燃料电池的反应原理,A正确;
B.焓变等于断裂化学键吸收的能量减去形成化学键释放的能量,则2436 kJ +498 kJ -4E(H-O)=-483.6,解得E(H-O)=463.4 kJ ,B正确;
C.由已知反应得到H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol1,而燃烧热是在1个标准大气压下,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,生成的水要为液态,但反应中生成的水为气态,若转化为液态还要放出热量,即H2的燃烧热ΔH<-241.8kJ·mol1,C正确;
O2(g)=H2O(g) ΔH=-241.8kJ·mol1,而燃烧热是在1个标准大气压下,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,生成的水要为液态,但反应中生成的水为气态,若转化为液态还要放出热量,即H2的燃烧热ΔH<-241.8kJ·mol1,C正确;
D.键能越大,键越牢固,由题可知,E(H-H)=436 kJ·mol1,E(H-O)=463.4 kJ·mol1,故E(H-O)>E(H-H),则H2O(g)中的H-O键更牢固,D错误。
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。